如何识别细胞污染?
现象1:细胞培养液变得浑浊,通常呈现米汤样的黄色液体,多半是细菌污染的迹象
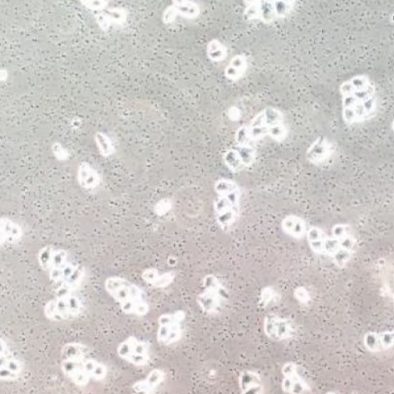
图示 | 细菌污染
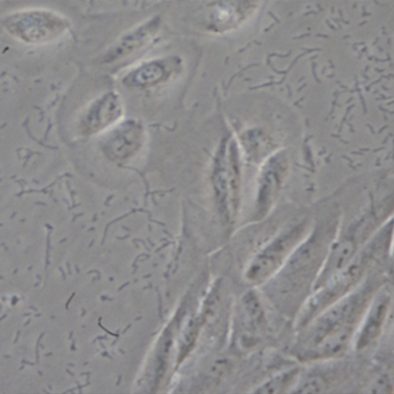
图示 | 杆菌污染
现象2:培养基内有活跃的小黑点,通常是黑胶虫污染的表现。
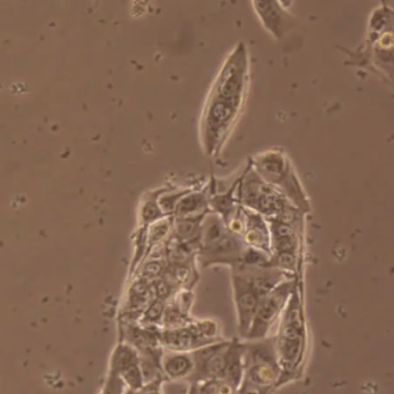
图示 | 黑胶虫
现象3:培养基虽然清澈,但可见漂浮的白色毛状物质,这可能是由于真菌感染引起的。

图示 | 真菌污染
处理方法:如果细胞污染,建议立即丢弃受污染的培养物,并用酒精棉球彻底清洁培养箱,随后进行半小时的紫外线消毒,防止二次污染。
此外,初学者在培养过程中可以在培养基中加入青霉素和链霉素以减少污染风险。

吉诺生物 | 青霉素-链霉素溶液(100x)
细胞培养过程中,细胞周围和细胞表面出现小黑点,应该怎么办?
现象:如果发现小黑点不动,可能是细胞碎片或支原体污染。
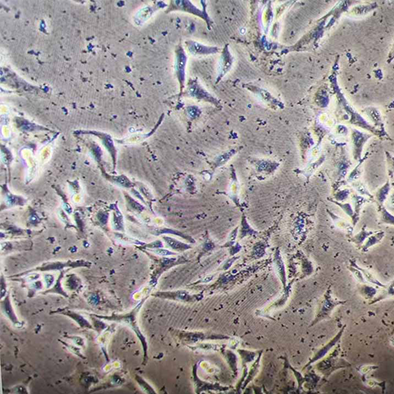
图示 | 细胞碎片
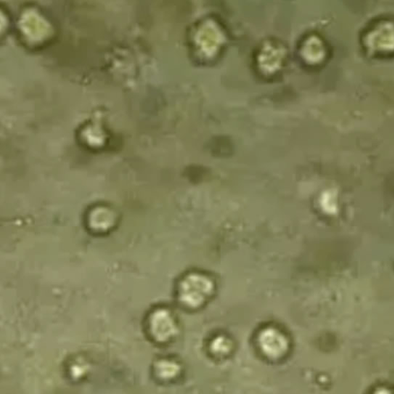
图示 | 支原体污染
处理方法:
对于悬浮细胞:收集上清液,低速离心(500~600rpm/min,5~6min),然后更换新的培养瓶。
对于贴壁细胞:使用PBS冲洗2~3次,轻拍培养瓶以去除不牢固的碎片,然后弃去PBS。接下来,使用低浓度的胰酶(如0.05%)消化1分钟左右,以去除间隙中的碎片,再进行正常消化和培养。如果怀疑是支原体污染,建议进行检测,阳性结果的细胞应尽快处理并丢弃。对于珍贵的细胞,可以尝试使用支原体清除剂(如泰乐菌素等)并与其他细胞分开培养。
预防方法:掌握细胞传代的最佳时机,避免细胞过度生长;控制消化时间,防止消化过度产生碎片;减少血清等试剂的冻融次数;调节培养液的pH至最佳状态;确保水质和器皿清洁。

吉诺生物 | PBS缓冲液
细胞表面有许多死细胞,传代时一直存在,如何应对?
现象:贴壁细胞表面附着许多死细胞团。
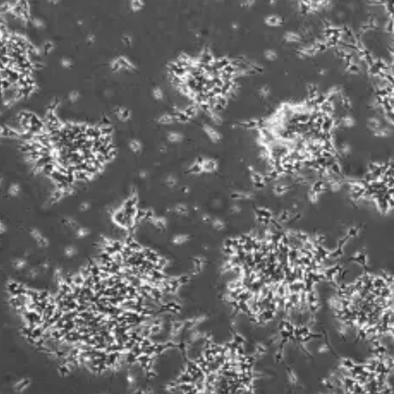
图示 | 细胞表面一些死的细胞团
处理方法:经过多次实践证明,有效的方法是用PBS冲洗两次,然后加入胰酶,轻轻晃动后立即倒出,再次用PBS冲洗,随后正常消化。由于死细胞附着力较弱,第一次加入胰酶后会脱落,第二次消化的细胞则是活性较强的。经过2~3次传代,细胞状态通常会恢复良好。
吉诺生物 | 0.25%胰酶(含酚红)
如果细胞质疏松,细胞状态不佳,如何改善?
处理方法1:更换或提高血清浓度,将其提升至15%~20%,培养48小时后再换回正常的10%浓度。高浓度血清的长期使用可能对细胞有毒性。
处理方法2:除了调整血清浓度外,还可以增加细胞密度,从培养瓶转移至六孔板或十二孔板。高密度培养可以通过旁分泌途径促进肿瘤细胞的生长。
预防措施:细胞质疏松和老化的主要原因是传代次数过多或胰酶消化时间过长。控制传代次数和消化时间,避免因消化过度导致细胞状态不佳和胞质疏松。
细胞传代
根据细胞生长特性,传代可分为悬浮细胞传代和贴壁细胞传代两种类型。对于悬浮细胞,可以加入等量的新鲜培养基后直接吹打分散传代,或离心后更换新培养基再吹打分散传代;贴壁细胞则采用消化法传代。以下是传代培养中的一些注意事项。
图片
贴壁细胞传代时如何使用胰酶?
通常使用 trypsin-EDTA 浓度为 0.25% trypsin-0.53 mM EDTA.2Na 或 0.05% trypsin-0.02 mM EDTA.2Na。
若消化液浓度过高,会导致培养基中细胞碎片和黑渣子增多。建议常规细胞传代时使用0.05%胰酶进行消化;对于难消化的细胞,可采用0.25%胰酶进行消化。当细胞密度超过80%时,可采用分步消化法。
胰酶应储存在–20°C,解冻在4°C进行。首次开瓶后,建议分装于无菌试管中,避免反复冷冻解冻以维持胰酶活性,并减少污染机会。
如何控制胰酶消化时间?
胰酶消化过度会导致细胞碎片和黑渣子增多,细胞大片脱落,严重影响细胞活性。消化不足则细胞难以从瓶壁上脱落,反复吹打可能损伤细胞。因此,控制胰酶消化时间尤为重要。
不同细胞对消化液的敏感性不同,胰酶消化时间也有所不同。对于新购买的细胞,建议先用低浓度胰酶摸索消化时间,每隔1分钟在显微镜下观察细胞是否变圆,并记录最佳消化时间,以便下次参考。
如何处理细胞抱团现象?
悬浮细胞在高密度下容易抱团,抱团细胞易死亡并影响周围细胞的生长。可以通过筛网去除较大的细胞团,或者将细胞悬液收集到15mL离心管中,静置20分钟,小心取上层细胞上清液继续培养(此方法只能去除部分较大的细胞团)。
细胞内出现空泡,是否正常?
部分细胞本身存在一定的空泡,如HepG2,Ishikawa等耐药株,这属于正常现象。如果只有少数细胞出现极少空泡,可能是细胞状态不佳。可以通过调整血清浓度、控制消化和传代时间来改善细胞状态。
如果大部分细胞出现空泡且数量较多,可能是细胞代次较高导致的老化,应更换早期代次的细胞。
细胞生长变慢的原因?
·消化过度
·传代过密
·营养不良
·细胞状态不佳或老化
·细胞存在污染
细胞不贴壁的原因及解决办法
胰酶处理时间:消化不够会导致细胞成团,消化过度则易损伤细胞膜蛋白,使细胞贴壁不紧,严重时可能导致细胞死亡。建议缩短胰蛋白酶消化时间或降低胰蛋白酶浓度。
缺少贴壁因子:血清中含有促进细胞贴壁的因子,无血清培养基中因缺少此类因子,贴壁效果会下降。解决办法是更换血清。
污染:支原体或细菌的污染会导致细胞贴壁不良。应分离培养物,检测支原体,并清洁培养箱。若确认污染,应丢弃受污染的培养物。
培养液配置或储存不当:培养液pH值过高或过低、无菌操作不当等都会影响细胞贴壁。
细胞冻存与复苏
细胞的冻存和复苏是维持细胞株长期稳定性和保存重要细胞资源的关键步骤。以下是一些细胞冻存与复苏的要点及注意事项:
细胞冻存前的准备工作
细胞状态:确保细胞处于良好的状态,无污染且生长旺盛,细胞密度一般控制在70%-90%之间。建议在传代1-2天后进行冻存,此时细胞的活力较高。
培养基的选择:使用含有10%FBS(胎牛血清)和DMSO(二甲基亚砜)的培养基作为冻存液。通常,冻存液的配方为90%完全培养基+10%DMSO,或80%完全培养基+20%FBS+10%DMSO。
细胞的收集:对于贴壁细胞,使用胰酶消化后收集细胞,悬浮细胞则直接离心收集。建议在1000rpm离心5分钟后弃去上清,加入适量冻存液重新悬浮细胞。

吉诺生物 | 胎牛血清(优级)
冻存操作步骤
分装:将悬浮好的细胞液按1-1.5mL体积分装到冻存管中,确保管口密封良好。
降温速率:冻存过程中,降温速率对细胞的存活率至关重要。通常采用程序降温法,将细胞在4°C冷藏10-15分钟,然后转移到-20°C冷冻30分钟,再转移到-80°C过夜。最终,将冻存管移至液氮罐中长期保存。通过缓慢降温,防止细胞内冰晶形成,减少细胞损伤。
吉诺生物 | 无血清细胞冻存液
细胞复苏
复苏速度:复苏时应尽量快速解冻,以减少冰晶对细胞的损害。通常将冻存管从液氮罐中取出后,立即放入37°C的水浴中,快速摇晃,直至冰块完全融化。
去除DMSO:细胞复苏后,需尽快去除DMSO。将融化后的细胞液迅速转移到10mL含有10%FBS的预温培养基中,1000rpm离心5分钟后弃去上清,再加入新鲜培养基悬浮细胞,接种到培养瓶中。
培养观察:复苏后的细胞应置于37°C、5%CO2培养箱中静置培养,24小时后更换培养基,去除死细胞及残余DMSO。随后,按常规进行细胞传代和培养。
细胞冻存和复苏的常见问题
冻存细胞活力低下:可能与冻存液配方不当、降温速率过快或复苏操作不当有关。建议优化冻存条件,确保每一步操作严格按照标准进行。复苏后细胞贴壁
不良或增殖缓慢:可能是由于DMSO残留、细胞状态不佳或细胞损伤导致。可以通过多次清洗去除DMSO,调整培养基成分,或在复苏初期提高血清浓度,促进细胞恢复。
冻存细胞长期保存的稳定性:细胞在液氮中长期保存可以维持较高的存活率,但在-80°C长期保存可能会影响细胞活力。建议冻存后尽量在液氮罐中保存。
以上是细胞培养、传代、冻存与复苏的详细指南,希望对您的细胞实验有所帮助。如果遇到其他问题或需要更多建议,欢迎随时联系吉诺生物!
| 货号 | 产品名称 | 规格 |
|---|---|---|
GNM15140-1 | 青霉素-链霉素溶液(100×) | 100ml |
GNM20012-5 | PBS缓冲液 PH7.2 | 500ml |
GNM15050-1 | 0.25%胰酶 含酚红 | 100ml |
GNMFBCP5 | 胎牛血清(优级) | 500ml |
GNMA1042 | 无血清细胞冻存液 | 100ml |