逆转录病毒(Retrovirus):是一种RNA病毒,在复制时需在逆转录酶的作用下首先将RNA转变为cDNA,再在DNA复制、转录、翻译等蛋白酶作用下扩增。主要包括RNA肿瘤病毒、慢病毒及泡沫病毒等三种亚科。慢病毒(Lentivirus):属于逆转录病毒科,名称源自该种病毒长达数年的潜伏期。经典的慢病毒是由HIV病毒改造而来,而且HIV-1/HIV-2系统也得到了广泛的应用,除了HIV病毒系统以外,后续还有猿类免疫缺陷病毒(simian immunodeficiency virus, SIV)载体系统、猫免疫缺陷病毒(felines immunodeficiency virus, FIV)载体系统、绵羊梅迪-维斯纳病毒(MMV)载体系统和马传染性贫血(EIA)载体系统等。
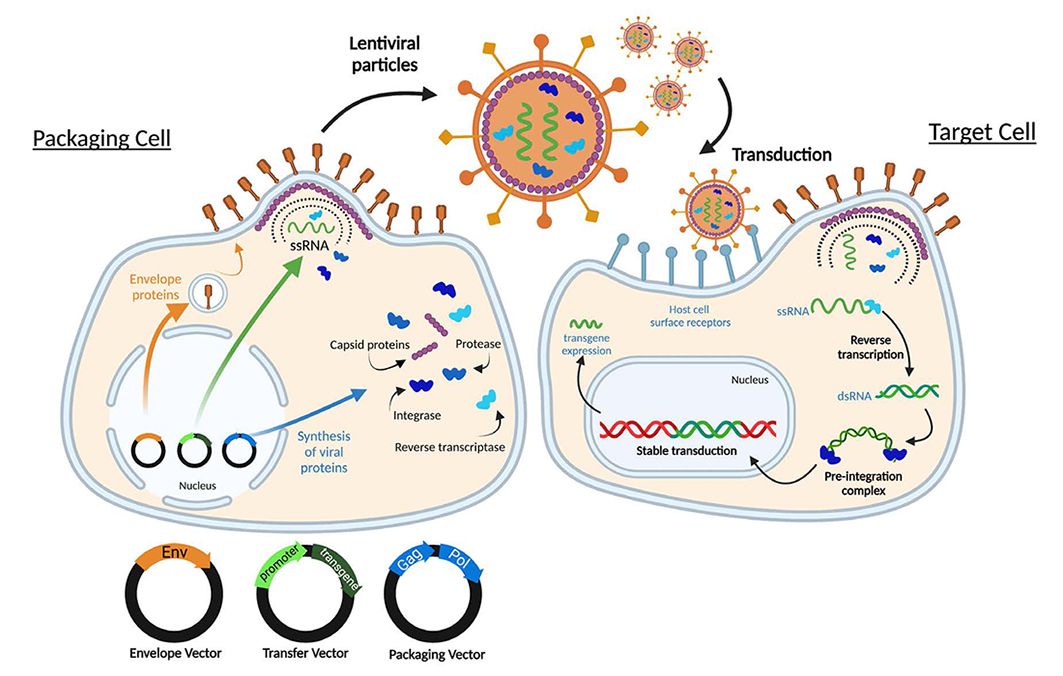
慢病毒优势:
1、慢病毒携带的基因组可整合到宿主基因组,使宿主细胞长时间稳定表达外源基因;
2、可感染分裂和非分裂细胞;
3、低免疫原性,直接注射活体组织不易造成免疫反应,适用于动物实验;
4、可以更换特异性启动子;
5、野生型的HIV大小约为9.8 kb,插入片段可长达5-6 kb;
慢病毒载体
慢病毒载体(Lentivirus)是一类改造自人免疫缺陷病毒(HIV)的病毒载体,是逆转录病毒的一种,基因组是RNA,其毒性基因已经被剔除并被外源性目的基因所取代,属于假型病毒。可利用逆转录酶将外源基因整合到基因组中实现稳定表达,具有感染分裂期与非分裂期细胞的特性。
慢病毒载体优势:
1、长期稳定的基因表达:由于基因被整合到宿主细胞基因组中,慢病毒载体能够提供长期、稳定的外源基因表达,适用于需要长时间观察的实验或治疗。
2、广泛的细胞感染能力:慢病毒可以感染多种类型的细胞,既包括分裂中的细胞,也包括不分裂的细胞,使其成为在研究复杂细胞类型中的理想选择。
3、低免疫原性:慢病毒载体引发的免疫反应相对较弱,因此在体内实验或基因治疗中更为安全,降低了因免疫反应引发的不良反应的风险。
4、适用于原代细胞和难转染细胞:慢病毒可以有效转导原代细胞以及其他难以通过传统方法转染的细胞,比如干细胞和神经元等。
5、相对较大的基因载体容量:慢病毒载体能够携带较大外源基因片段,能够满足更多复杂基因操作的需求。
6、适合基因治疗:因其长期稳定的基因表达能力和较低的免疫原性,慢病毒载体已被广泛用于基因治疗研究,尤其是慢性疾病和遗传病的治疗。
应用前景:
1、构建稳定表达细胞系:慢病毒载体能侵染各类细胞,且可携带荧光标记等信号,是构建细胞系的常用有效载体。
2、RNA干扰技术:RNA干扰(RNA interference,RNAi)技术是一种小分子双链RNA介导的分子沉默机制,可以高效下调目的基因表达,是抗病毒治疗的新手段。慢病毒载体作为RNAi研究的有效辅助手段,可以感染各种分裂时期细胞并实现稳定表达。在了解病毒毒力蛋白的基础上,以慢病毒为载体构建靶向某个病毒致病基因位点的shRNA进行细胞试验或动物回归试验,通过检测mRNA复制水平及病毒滴度测定等方法可以确定基因沉默效果及对病毒复制能力的抑制情况。
3、靶基因及通路筛选:病毒侵袭宿主需要特定受体位点识别,并与靶基因相互作用激活信号传递、物质代谢、周期调控等复杂信号通路,利于病毒在宿主体内复制生存,因此找到靶基因可为病毒疾病治疗提供了一条新思路。慢病毒载体体系表达率高,可携带基因片段较长,极少诱发宿主产生免疫反应,是筛选靶基因的理想表达载体。
4、基因治疗 :基因治疗是指将外源基因导入细胞中,纠正或弥补由于基因缺陷所造成的疾病。导入的外源基因主要分为正常基因、治疗基因和“自杀基因”。转入正常基因或是能够发挥正常功能的该基因片段,可以弥补先天性的基因缺失从而发挥治疗作用,主要用于各类遗传病的治疗;而治疗基因主要是指转入对疾病具有明显治疗效果的靶基因;;“自杀基因”主要指胞嘧啶脱氨酶基因(CD)和编码胸苷激酶的基因(TK),可催化无毒的药物前体转变为细胞毒物质,杀死受体细胞。
5、疫苗研发 :当疾病发生时,疫苗免疫防控是避免其大规模流行的有效方式,在人及动物传染病预防治疗中均发挥重要作用。,慢病毒载体能感染非分裂细胞,也无需直接靶向致病性抗原,可用于抑制自身免疫性疾病。
6、生产转基因动物:以慢病毒作为载体,利用显微注射技术将外源基因导入动物胚胎中可以显著提高目的基因稳定表达率,甚至可以实现稳定的遗传性状,降低转基因动物生产成本。
7、生物反应器慢病毒载体以其稳定性、高效率、基因整合的天然优势成为构建生物反应器的首选工具,产生的转基因动物还能够形成稳定的后代遗传性状
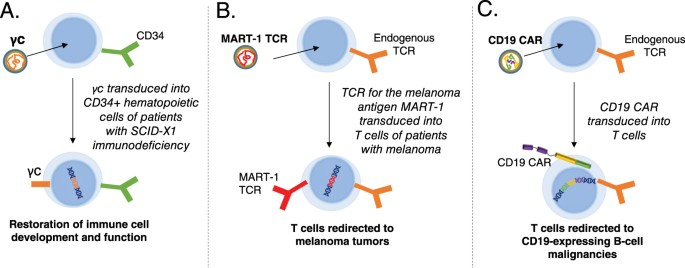
参考文献:
1. https://bpsbioscience.com/lentiviruses
2. https://resources.amsbio.com/Catalog/Viral%20Delivery%20systems%200522.pdf
3. Milone, M.C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia 32, 1529–1541 (2018). https://doi.org/10.1038/s41375-018-0106-0