Co-IP(co-immunoprecipitation,免疫共沉淀)被认为是识别或确认体内蛋白质相互作用事件发生的经典方法之一。该方法可以利用抗体从样品中捕获靶蛋白及其互作蛋白或复合体,能够特异性富集所研究的目标蛋白,由于过程中采用了非变性条件,保留了互作蛋白或复合体的胞内自然状态。
1. Co-IP实验原理
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y、Z等蛋白也能富集下来。目前多将protein A/G预先结合固化在磁珠上,使之与含有抗原和抗体的溶液孵育后,磁珠上的protein A/G就能通过抗体吸附抗原达到富集和筛选鉴定互作分子的目的。这种方法常用于测定两种目标蛋白质是否在体内结合,也用于探索特定蛋白质的新的互作搭档。
2. 实验流程图
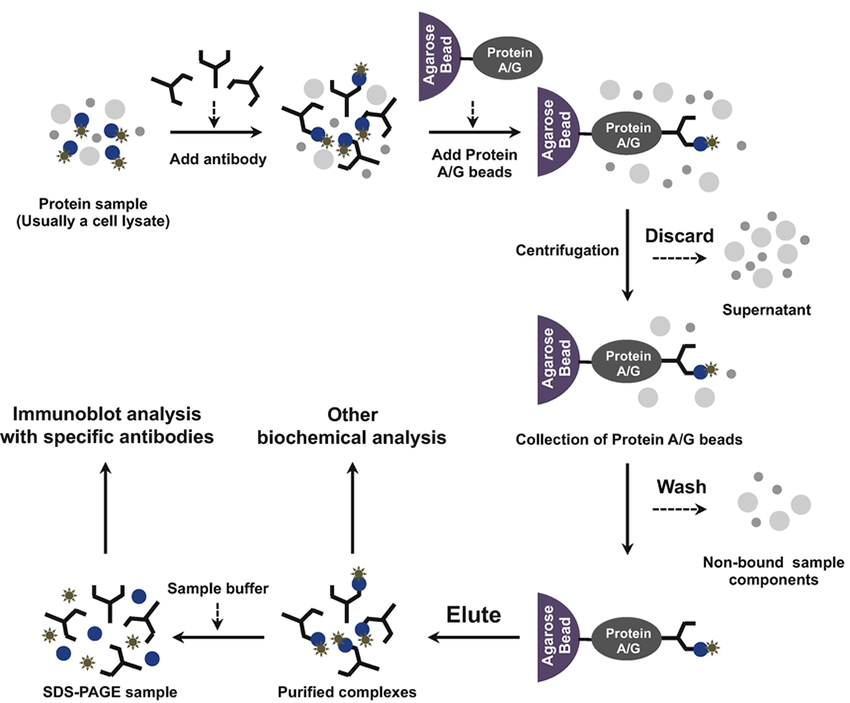
3. 实验步骤
3.1 免疫复合物的制备
3.1.1收集细胞,加入适量细胞裂解缓冲液(含蛋白酶抑制剂),冰上裂解30 min,细胞裂解液于4 ℃,最大转速离心30 min后取上清;将每个样品的细胞裂解液取部分与推荐量的IP抗体一起加入至1.5 mL离心管中,剩余细胞裂解液保留作为下游Western blot分析的input,除实验样品外,可设置IgG和beads组作为对照。
3.1.2用免疫沉淀裂解/漂洗缓冲液将抗体/裂解液稀释至500 μL。
3.1.3在室温下孵育1-2 h,或4 °C过夜,以形成免疫复合物。
3.2 免疫共沉淀
3.2.1将适量偶联蛋白A/G的磁珠加入到1.5 mL 离心管中。
3.2.2向含有磁珠的离心管中加入适量免疫沉淀裂解/漂洗缓冲液,轻柔颠倒离心管数次进行混匀。
3.2.3将离心管放入磁力架中收集磁珠到离心管的一边,去除上清。
3.2.4重复2-3步骤2-3次。
3.2.5将抗原样品/抗体混合物(步骤A)加入盛有磁珠的离心管中,保持混匀室温下孵育1-2 h。
3.2.6用磁力架收集磁珠,除去未结合的样品,保存以备分析。
3.2.7向离心管中加入适量免疫沉淀裂解/漂洗缓冲液,轻柔混匀,收集磁珠,弃上清。再重复洗涤3-5次。
3.2.8低pH洗脱:向离心管中加入适量洗脱液。保持混匀在室温下孵育10分钟。通过磁力架分离磁珠,保留含有目的蛋白的上清。
3.2.9含目的蛋白的上清液加入适量蛋白电泳上样缓冲液后可用于Western blot分
析或蛋白质谱鉴定。
4. 实验结果示例
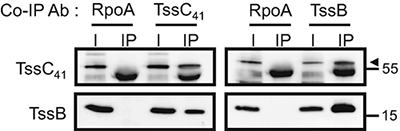
Co-IP实验验证TssC41和TssB之间的相互作用,RpoA作为阴性对照蛋白,TssC41能够将TssB拉下来,反过来TssB也能将TssC41拉下来
参考文献
[1] Lee C. Coimmunoprecipitation assay. Methods Mol Biol. 2007;362:401-6.
[2] Lin JS, Lai EM. Protein-Protein Interactions: Co-Immunoprecipitation. Methods Mol Biol. 2017;1615:211-219.
[3] Tang Z, Takahashi Y. Analysis of Protein-Protein Interaction by Co-IP in Human Cells. Methods Mol Biol. 2018;1794:289-296.