细胞周期是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程,通常将子细胞形成作为一次细胞分裂结束的标志。细胞的生命开始于产生它的母细胞的分裂, 结束于它的子细胞的形成,或是细胞的自身死亡。细胞凋亡(Apoptosis),或者说程序性细胞死亡(Programmed cell death),是细胞内建的防御机制之一,在生物的正常发育及疾病抵御中起到重要的作用,涉及一系列基因的激活、表达以及调控,是细胞为更好地适应环境而主动争取的一种死亡过程。具体表现为:出芽形成凋亡小体、核小体间DNA的切割,凋亡小体被吞噬和消化等几个连续过程等。
一、细胞周期
1. 实验原理
流式利用不同荧光物质标记的单克隆抗体,与待测成分作用,然后上流式细胞仪检测待测细胞。待测细胞随流动室内的流动鞘液排列成单列,一个个迅速通过激光聚焦区,激光在对每个细胞进行照射时可同时得到前向角散射和侧向角散射2种散射光以及激发荧光标记物发出的信号,利用这些信号,可计算出相对含量,从而得到细胞群的相对比值。细胞周期分为间期与分裂期两个阶段。间期又分为三期:即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。某些细胞在分裂结束后暂时离开细胞周期,停止细胞分裂,执行一定生物学功能(G0期)。由于细胞周期各时相的DNA含量不同,通常正常细胞的G1/ G0期具有二倍体细胞的DNA含量(2N),而G2/ M期具有四倍体细胞的DNA含量(4N),而S期的DNA含量介于二倍体和四倍体之间。PI可以与DNA结合,其荧光强度直接反映了细胞内DNA含量。因此,通过流式细胞仪PI染色法对细胞内DNA含量进行检测时,可以将细胞周期各时相区分为G1/G0期,S期和G2/M期。
2. 细胞周期实验步骤
2.1 细胞铺板处理
2.1.1 先将14个多孔材料置于基础培养基中浸泡 60 min。
2.1.2 0.25%胰酶37 ℃消化,细胞计数,调整细胞浓度为5×104个/μL。
2.1.3 浸泡完成后置于24孔超低贴附培养板中,每个支架滴加 100 μL 细胞悬液,静置30 min。
2.1.4 再用移液器将培养孔内残余的培养液吸出并再次滴加在多孔支架上,重复 4 次以使细胞可以充分均匀的粘附在多孔支架内。
2.1.5 接种完成之后将培养板置于培养箱中预培养2 h,等待细胞初步粘附。
2.1.6 每孔再次添加基础培养基没过材料置于培养箱中培养。
2.1.7 培养时间到后用胰酶消化,1000 g,离心5 min收集细胞。加入1 mL预冷的PBS重悬,再次离心细胞,小心去除上清。
2.1.8 加入1 mL预冷的70%乙醇重悬细胞,4 ℃ 固定24 h。
2.1.9 1000 g,离心5 min收集细胞,去除上清,加入1 mL预冷的PBS重悬,再次离心后吸除上清。
2.1.10 参考下表配制碘化丙啶染色液:
| 试剂 | 每个样品 |
| 染色缓冲液 | 0.5 mL |
| 碘化丙啶染色液(20×) | 25 μL |
| RNase A (50×) | 10 μL |
2.1.11 染色:每管细胞样品中加入0.5 mL碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37 oC避光温浴30 min。
2.1.12 流式检测:用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。
2.1.13 使用CellQuest软件分析细胞周期。
3. 实验结果示例
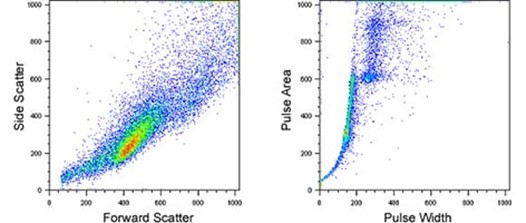
前向散射与侧向散射数据图,用于识别单个细胞;脉冲形状分析图,用于识别细胞团及粘合细胞;
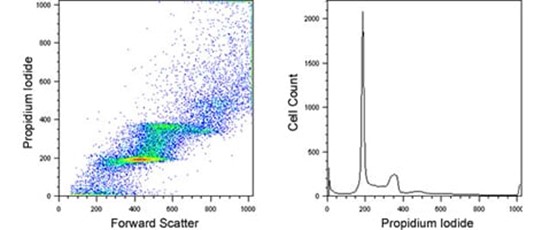
右下前向散射- PI 信号图;PI 直方图。
二、细胞凋亡
1.实验原理
Annexin V和PI双染法是流式检测细胞凋亡的经典方法,它是基于凋亡的早期细胞膜上的磷脂酰丝氨酸(phosphotidylserine,PS)从细胞膜的内侧翻转到细胞膜的表面这一原理来实现的。Annexin Ⅴ(膜联蛋白 V)是一种分子量为35-36 kDa的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,将Annexin V 进行荧光素FITC标记,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。而碘化丙啶(Propidium, PI)是一种可与DNA结合的染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI 能够透过细胞膜而使细胞核红染。因此,将Annexin V与PI联合使用时,便可用来鉴别活细胞,凋亡细胞及死亡细胞。
2.2 细胞凋亡实验步骤
2.2.1 细胞用不含EDTA的胰酶消化后,300 g,4 ℃离心5 min收集细胞。
2.2.2 用预冷的PBS洗涤细胞2次,每次300 g,4 ℃离心5 min。
2.2.3 吸弃PBS,加入100 μL 1×Bingding Buffer重悬细胞。
2.2.4 加入5 μL Annexin-V-FITC和10 μL PI Staining Solution进行双重染色。
2.2.5 避光、室温反应15 min。
2.2.6 加入400 μL 1×Bingding Buffer,混匀放置冰上并立即用流式细胞仪检测。
2.2.7 使用CellQuest软件分析细胞凋亡的比例。
3. 实验结果示例
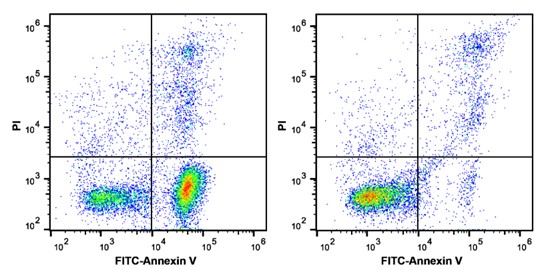
实验组(左)和对照组(右)经Annexin V和PI双染法流式检测结果:Annexin V-FITC单阳为早期凋亡细胞,Annexin V-FITC和PI双阳细胞为坏死或晚期凋亡细胞,PI单阳细胞为裸核细胞。
参考文献
[1] Rieger A M, Nelson K L, Konowalchuk J D, et al. Modified Annexin V/Propidium Iodide Apoptosis Assay For Accurate Assessment of Cell Death[J]. Journal of Visualized Experiments Jove, 2011(50).
[2] Crowley L C, Marfell B J, Scott A P, et al. Quantitation of Apoptosis and Necrosis by Annexin V Binding, Propidium Iodide Uptake, and Flow Cytometry[J]. Cold Spring Harbor Protocols, 2016, 2016(11):pdb.prot087288.
[3] Rieger A M, Barreda D R. Accurate Assessment of Cell Death by Imaging Flow Cytometry[M]. Methods Mol Biol, 2016.
[4] Sawai H, Domae N. Discrimination between primary necrosis and apoptosis by necrostatin-1 in Annexin V-positive/propidium iodide-negative cells[J]. Biochemical & Biophysical Research Communications, 2011, 411(3):569-573.
[5] Pietkiewicz S, Schmidt J H, Lavrik I N. Quantification of apoptosis and necroptosis at the single cell level by a combination of Imaging Flow Cytometry with classical Annexin V/propidium iodide staining[J]. Journal of Immunological Methods, 2015, 423:99-103.