细胞增殖(cell proliferation)是生物体生长、发育、繁殖以及遗传的基础,是生活细胞的重要生理功能之一,是生物体的重要生命特征。细胞增殖是评价细胞代谢、生理和病理状况的重要指标,常用的检测方法有BrdU染色、EdU染色和克隆形成等。
一、Brdu/EdU染色
1. 实验原理
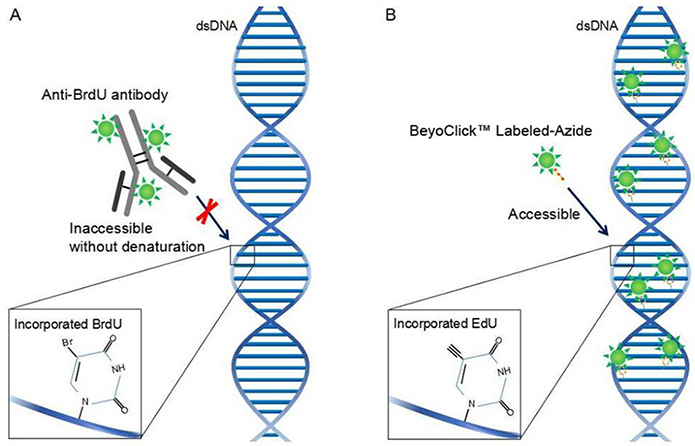
BrdU(5-Bromo- 2'-deoxuuridine)是胸腺嘧啶的衍生物,可替代胸腺嘧啶选择性整合到新合成的DNA中(细胞周期S期)。这种掺入可以稳定存在,并随着DNA复制进入子细胞中。利用BrdU特异性抗体可以检测掺入的BrdU,进而判断细胞的增殖能力。EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,能够在DNA复制时期代替胸腺嘧啶掺入正在合成的DNA分子中,并基于Apollo®荧光染料与EdU的特异性反应即可直接地检测出细胞的增殖能力。虽然BrdU和Edu两种方法都能检测细胞的增殖能力,但两者也有不同。Brdu抗体较大,必须先对DNA进行部分变性形成单链,才能与BrdU结合进而完成检测;而EdU只有BrdU抗体大小的1/500,在细胞内更容易扩散,无需DNA变性即可有效检测,可有效地避免样品损伤,具有更高的灵敏度和更快的检测速度。
2. 实验原理图
3. 实验步骤
3.1 BrdU染色
3.1.1 取对数生长期细胞,以每孔1×105个细胞(具体密度取决于细胞的生长率)接种到96孔板中,待细胞恢复到正常状态后,进行所需的药物处理或者其它刺激处理;
3.1.2 添加配制的 10× BrdU溶液到平板孔中,以获得1×的最终浓度。
3.1.3 将细胞放入恒温器。一般的孵育时间为 1-24 h;
3.1.4 去除培养基。如是悬浮细胞,则以300 g的离心力离心10 min,随后弃去培养基;
3.1.5 按100 μL/孔添加 Fixing/Denaturing Solution,并将平板放在室温下静置30 min,弃去溶液;
3.1.6 按100 μL/孔添加配制的1×BrdU抗体溶液,并将平板放在室温下1 h;
3.1.7 弃去溶液,用 1× Wash Buffer洗涤 3 次;
3.1.8 按 100 μL/孔添加配制的1× HRP标记二抗溶液,并将平板放在室温下 静置30 min,弃去溶液;平板用1× Wash Buffer洗涤 3 次。
3.1.9 添加 100 μL TMB Substrate;
3.1.10 室温孵育30 min;
3.1.11 添加 100 μL STOP Solution;
3.1.12 读取在450 nm处的吸光度(要获得最佳读数,则在添加 STOP Solution 30 min内读取平板)。
3.2 EdU染色
3.2.1 培养细胞的EdU标记及固定、洗涤和通透
3.2.1.1 取对数生长期细胞,以每孔1×105个细胞(具体密度取决于细胞的生长率)接种到96孔板中,待细胞恢复到正常状态后,进行所需的药物处理或者其它刺激处理;
3.2.1.2 配制2× EdU工作液,37 ℃预热后,等体积加入96孔板中,使96孔板中的EdU终浓度变为1×。更换所有的培养液可能会对细胞的增殖有影响,因此不建议替换所有的培养液;
3.2.1.3 继续孵育细胞2 h。该孵育时间的长短取决于细胞生长速率,通常孵育时间为该细胞周期的10%左右;
3.2.1.4 EdU标记细胞完成后,弃去培养液,并加入1 mL固定液,室温固定15 min。
3.2.1.5 弃去固定液,每孔用1mL洗涤液洗涤细胞3次,每次5 min。
3.2.1.6 弃去洗涤液,每孔用1mL通透液室温孵育15 min。
3.2.1.7 弃去通透液,每孔用1mL洗涤液洗涤细胞2次,每次5 min。
3.2.2 EdU检测
96孔板中每孔的反应体系为50 μL的反应混合物,6、12、24、48和384孔板对应的反应混合物体系分别为500 μL、200 μL、100 μL、70 μL和20 μL。
3.2.2.1去除上述孔中的洗涤液,每孔加入50 μL Click反应液(参考下表组分顺序和体积配制Click反应液,并且在配制后15 min内使用),轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品;
3.2.2.2 室温避光孵育30 min。
3.2.2.3 吸除Click反应液,用洗涤液洗涤3次,每次5分钟。
3.3.3 细胞核染色
为了检测细胞增殖的比例,可以考虑使用Hoechst 33342进行细胞核染色。
3.3.3.1 吸除洗涤液后,每孔加1×Hoechst 33342溶液1mL,室温避光孵育10分钟。
3.3.3.2 吸除1× Hoechst 33342溶液。
3.3.3.3 用洗涤液洗涤3次,每次5分钟。
3.3.3.4 随后即可进行荧光检测。Hoechst 33342为蓝色荧光,最大激发波长为346 nm,最大发射波长为460 nm
4. 结果示例
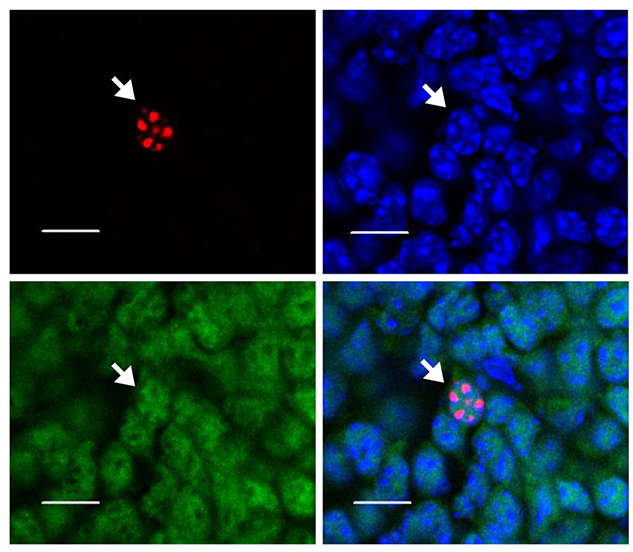
EdU标记正在进行DNA复制的细胞,在荧光显微镜下呈绿色;Hoechst 33342标记细胞的细胞核,显微镜下呈蓝色。绿色标记为NeuN。
二、细胞克隆形成实验
1. 实验原理
细胞克隆形成实验是用来检测细胞增殖能力、侵袭性、对杀伤因素敏感性等项目的重要技术方法。所谓克隆就是当单个细胞在体外增殖6代以上,其后代所组成的细胞群体。细胞克隆形成率表示接种细胞后贴壁的细胞成活并形成克隆的数量,反映细胞群体依赖性和增殖能力。由于细胞生物学性状不同,克隆形成率差别也很大。一般正常细胞克隆形成率弱,肿瘤细胞克隆形成率强。克隆形成依据采用的培养介质的不同,分为平板克隆和软琼脂克隆两类。平板克隆形成实验主要应用于贴壁的细胞。软琼脂克隆形成实验主要应用于悬浮的肿瘤细胞和转化细胞系。
2. 实验原理图
3. 实验步骤
3.1 平板克隆形成
3.1.1 将处于对数生长期的细胞胰酶消化后,完全培养基(基础培养基+10%胎牛血清)重悬成细胞悬液,并计数;
3.1.2 培养板(6孔板)中接种400-1000个细胞/孔(根据细胞生长情况确定,一般为700个细胞/孔);
3.1.3 继续培养到14天或绝大多数单个克隆中细胞数大于50为止,中途每隔3天进行换液并观察细胞状态;
3.1.4 弃去培养基,PBS洗涤1次,每孔加入1 mL 4%多聚甲醛固定30-60 min;
3.1.5 用PBS洗涤1次,每孔加入结晶紫染液1mL,染细胞10-20 min;
3.1.6 用PBS洗涤细胞数次,晾干,相机拍照(分别对整个六孔板及每个孔进行单独拍照);
3.2 软琼脂克隆形成
3.2.1 配制1.2%和0.7%琼脂糖,高压灭菌后,维持在42 ℃使其保持融化状态;
3.2.2 将1.2%琼脂糖胶与2×培养基1:1混合,铺入6孔板作为下层胶,每孔1.5 mL,室温等其凝固;
3.2.3 将处于对数生长期的细胞胰酶消化后,完全培养基(基础培养基+10%胎牛血清)重悬成细胞悬液,并调整细胞浓度为5×104/mL;
3.2.4 将0.7%琼脂糖胶与2×培养基1:1混合,加入100 μL细胞悬液,混合均匀后,加入6孔板作为上层胶,每孔1.5 mL。
3.2.5 待其凝固后,再在上面加入培养基,每3天更换一次;
3.2.6 根据细胞的生长速度培养2-3周后显微镜下观察克隆大小,与平板克隆一样,每个克隆>50个细胞,显微镜拍照。若拍整个孔,每孔加入200 μL氯化硝基四氮唑蓝(NBT)染色,37 ℃过夜,拍照。
4. 实验结果示例
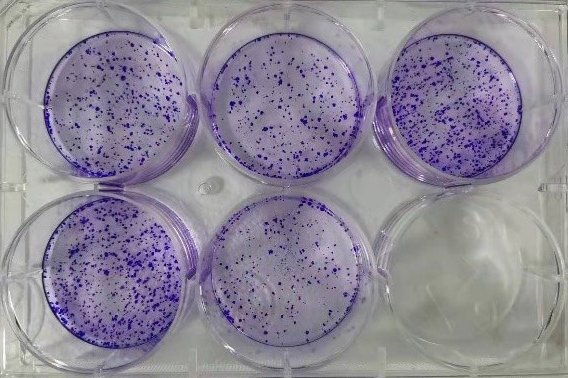
平板克隆形成。细胞克隆形成后,经结晶紫染色呈蓝色;在相同的接种细胞数量下,细胞克隆的数量越多,细胞增殖能力越强。
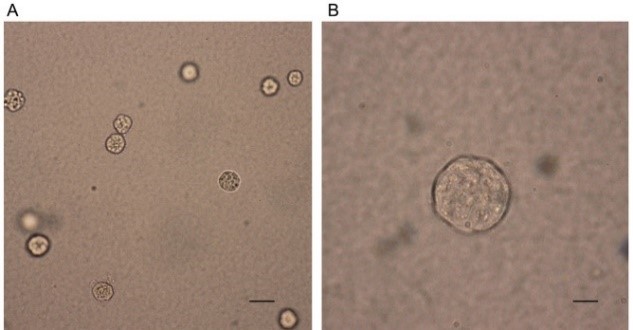
软琼脂克隆形成。显微镜下可以看到分散的细胞克隆,克隆数占接种细胞数的比值可以衡量细胞的增殖能力;比值越高,增殖能力越强。
参考文献
[1] Matatall KA, Kadmon CS, King KY. Detecting Hematopoietic Stem Cell Proliferation Using BrdU Incorporation. Methods Mol Biol. 2018;1686:91-103.
[2] Crane AM, Bhattacharya SK. The use of bromodeoxyuridine incorporation assays to assess corneal stem cell proliferation. Methods Mol Biol. 2013;1014:65-70.
[3] Diermeier-Daucher S, Clarke ST, Hill D, Vollmann-Zwerenz A, Bradford JA, Brockhoff G. Cell type specific applicability of 5-ethynyl-2'-deoxyuridine (EdU) for dynamic proliferation assessment in flow cytometry. Cytometry A. 2009 Jun;75(6):535-46.
[4] Angelozzi M, de Charleroy CR, Lefebvre V. EdU-Based Assay of Cell Proliferation and Stem Cell Quiescence in Skeletal Tissue Sections. Methods Mol Biol. 2021;2230:357-365.
[5] Tang H, Liu J, Huang J. GMFG (glia maturation factor gamma) inhibits lung cancer growth by activating p53 signaling pathway. Bioengineered. 2022 Apr;13(4):9284-9293.
[6] Du F, Zhao X, Fan D. Soft Agar Colony Formation Assay as a Hallmark of Carcinogenesis. Bio Protoc. 2017 Jun 20;7(12):e2351.