活体成像技术(in vivo imaging technique) 是指在不对实验动物造成伤害的前提下,应用影像学方法,利用一套非常灵敏的光学检测仪器对活体状态下的生物过程进行细胞和分子水平的定性和定量研究的技术。实验者可借此技术非侵入式、直观地观测活体动物体内肿瘤的生长,转移、疾病的发展过程、基因的表达变化等生物学过程,实现对同一实验对象不同时间点各种生物学行为进行跟踪观察。因其操作极其简单、所得结果直观、灵敏度高、实验成本低等特点,目前已广泛应用于生命科学、医学研究及药物开发等领域。
1. 实验原理
1.1光学原理
光在哺乳动物组织内传播时会被散射和吸收,光子遇到细胞膜和细胞质时会发生折射现象,而且不同类型的细胞和组织吸收光子的特性并不一样。在偏红光区域,大量的光可以穿过组织和皮肤而被检测到。在相同的深度情况下,检测到的发光强度和细胞的数量具有非常好的线性关系。可见光体内成像技术的基本原理在于光可以穿透实验动物的组织并且可由仪器量化检测到的光强度,同时反映出细胞的数量。
1.2标记原理
目前活体成像技术主要采用生物发光(Bioluminescence)与荧光(Fluorescence)两种技术。
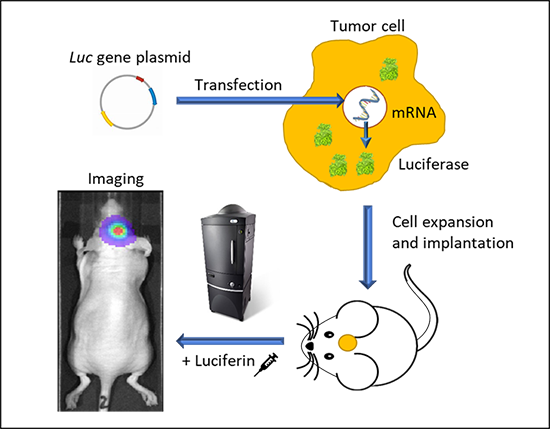
生物发光技术是在哺乳动物体内,将荧光素酶(Luciferase)基因标记细胞或者DNA,即将荧光素酶基因整合到细胞染色体DNA上以表达荧光素酶,当外源(腹腔或静脉注射)给予其底物荧光素(luciferin),即可在几分钟内产生发光现象。这种酶在ATP及氧气的存在条件下,催化荧光素的氧化反应才可以发光,因此只有在活细胞内才会产生发光现象,并且光的强度与标记细胞的数目线性相关。
基因、细胞和活体动物都可被荧光素酶基因标记。标记细胞的方法基本上是通过分子生物学克隆技术,将荧光素酶的基因插到预期观察的细胞的染色体内,通过单克隆细胞技术的筛选,培养出能稳定表达荧光素酶的细胞株。将标记好的细胞注入小鼠体内后,观测前需要注射荧光素酶的底物—荧光素。荧光素脂溶性非常好,很容易透过血脑屏障。注射一次荧光素能保持小鼠体内荧光素酶标记的细胞发光30-45分钟。每次荧光素酶催化反应只产生一个光子,利用生物光学分子成像系统,应用一个高度灵敏的制冷CCD相机及特别设计的成像暗箱和成像软件,可观测并记录到这些光子。
荧光技术是应用荧光蛋白(如绿色荧光蛋白GFP, 红色荧光蛋白DsRed等荧光报告基团)标记细胞或蛋白,通过激发光激发荧光基团到达高能量状态,荧光基团吸收激发光后产生荧光形成体内的生物光源,通过高灵敏度的仪器对发射光进行检测的方法。
2. 实验步骤
2.1细胞标记
2.1.1质粒的扩增和纯化
制备带有荧光素luc转酶报告基因或编码荧光蛋白基因的真核表达质粒并进行扩增纯化。
2.1.2细胞转染
取对数生长期的目标细胞,将细胞接种于6孔板内待细胞融合度达到80%~90%孔培养板中,TM即可转染。进行转染时,将目标细胞、脂质体转染试剂及足量的质粒载体悬浮液共培养6h,之后补充新鲜的培养液。
2.1.3单克隆细胞筛选
转染48h后用胰酶消化细胞,以1:6比例接种到6孔板中,同时加入抗生素G418,随后每2d更换一次培养基并维持G418筛选直至单细胞抗性克隆的出现。分别挑选单一抗性克隆至96孔板,待其逐渐增殖后转入24孔板中继续传代培养。
2.1.4荧光素酶活性鉴定阳性克隆,筛选稳定高表达的细胞株
单一抗性克隆传代至第五代时用LuciferaseAs-sayAystem检测荧光素酶活性。检测时,各克隆按1×105个/孔接种到24孔板,24h后细胞裂解液裂解,12000r,4℃离心10min,收集裂解物,取上清10μl加入96孔白板中,向每孔加入50μl荧光素酶96microplateluminometer连续读底物,停留2s后,取10s的荧光值(RLU),每个克隆设3个复孔,保留RLU值高的细胞克隆继续传代培养,再过5代后进行荧光素酶活性检测。保留RLU值维持较高的克隆直至第30代,荧光素酶活性最高的几个克隆MCF-7-luc即为阳性克隆。将筛选出高效表达,阳性率接近100%的细胞株进行培养。
2.2构建动物模型
根据实验目的选择尾静脉注射、皮下移植、原位移植等方法接种已标记的细胞。
2.3活体成像
2.3.1小鼠经过麻醉系统被麻醉后放入成像暗箱平台,软件控制平台的升降到一个合适的视野,自动开启照明灯拍摄第一次背景图。
2.3.2自动关闭照明灯, 在没有外界光源的条件下拍摄由小鼠体内发出的光,即为生物发光成像。与第一次的背景图叠加后可以清楚的显示动物体内光源的位置,完成成像操作。荧光成像应选择合适的激发和发射滤片,生物发光则需要成像前体内注射底物激发发光。
2.3.3利用软件完成图像分析过程。使用者可以方便的选取感兴趣的区域进行测量和数据处理及保存工作。当选定需要测量的区域后,软件可以计算出此区域发出的光子数,获得实验数据。
3. 实验结果示例
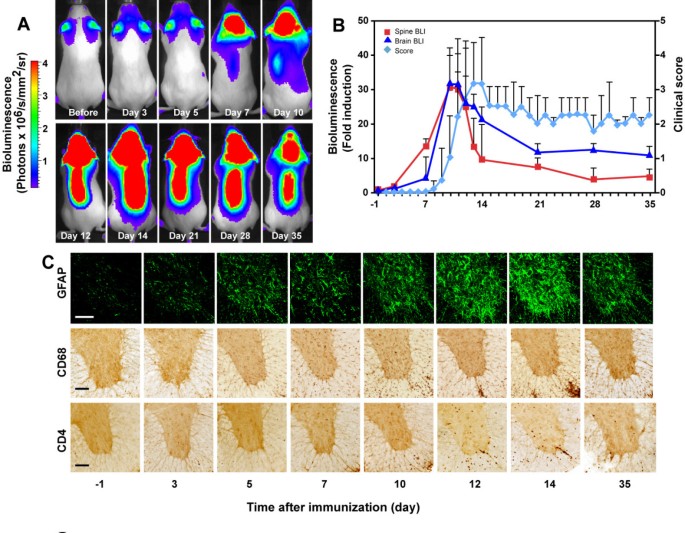
利用生物发光成像方法对实验性自身免疫性脑脊髓炎(EAE)模型小鼠中非侵入性地测量不同时间点大脑和脊髓中的生物发光,并在不同时间点处死小鼠以评估临床和病理变化。采用Pearson相关分析统计生物发光与临床病理EAE的相关性。
4. 参考文献
[1] Luo, J. , Ho, P. , Steinman, L. , & Wyss-Coray, T. . (2008). Bioluminescence in vivo imaging of autoimmune encephalomyelitis predicts disease. Journal of Neuroinflammation,5,1(2008-02-01), 5(1), 6.
[2] Syed, A. J. , & Anderson, J. C. . (2021). Applications of bioluminescence in biotechnology and beyond. Chemical Society Reviews, 50,5668.
[3] Pogue, B. W. , Zhang, R. , Cao, X. , Jia, J. M. , & Vinogradov, S. A. . (2021). Review of in vivo optical molecular imaging and sensing from x-ray excitation. Journal of Biomedical Optics, 26(1).