细胞染色是一种通过化学或其他方法使细胞着色的技术,可直观的了解细胞生长状况、形态等细胞特性以及其中的分子表达水平与定位等,它包括细胞免疫化学染色、细胞免疫荧光染色、EdU/BrdU染色、TUNEL染色等。
一、细胞免疫化学染色
1.实验原理
免疫细胞化学染色(Immunocytochemistry,ICC)原理是通过引入附有标记物的外源性抗体(或抗原),使之锚定与细胞标本中相应的抗原(或抗体)部位,标记物经呈色反应从而显示待检抗原(或抗体),根据标记物的不同分为:免疫酶细胞化学染色、免疫荧光细胞化学染色等。
2.实验原理图
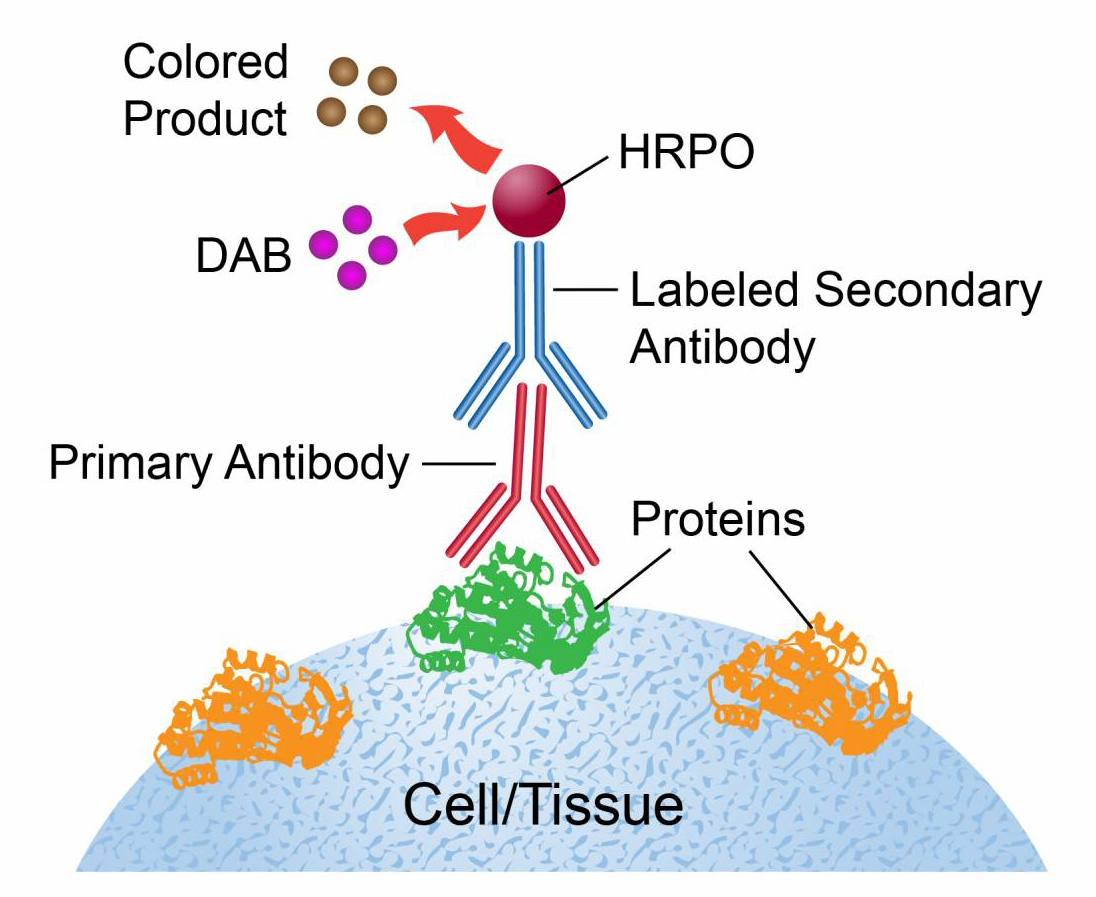
3.实验步骤
3.1 取对数生长期的细胞,以2×105个/mL的密度接种于24孔板中,混匀,使其呈单细胞层,并置于37 ℃,5% CO2培养箱中培养24 h;
3.2 弃去培养基,使用PBS漂洗3遍,95%丙酮固定10 min;
3.3 PBS漂洗3次,每次2 min;
3.4 0.3% Triton X-100通透15 min;
3.5 PBS漂洗3次,每次2 min;
3.6 加入10%羊血清封闭,37 ℃孵育30 min;
3.7 吸弃上清,加入一抗,置于湿盒内,37 ℃反应1 h或 4 ℃冰箱过夜;
3.8 PBS漂洗3次,每次2 min;
3.9 加入多聚物酶标记的HRP二抗,室温孵育30 min;
3.10 PBS漂洗3次,每次2 min;
3.11 加入DAB(3,3-二氧己联苯胺)显色10 min;
3.12 加入PBS清洗2次,终止呈色反应;
3.13 加入苏木精2 min,PBS清洗一次,迅速过盐酸酒精分化,PBS清洗1次;
3.14 显微镜下观察、拍照。
4.实验结果示例
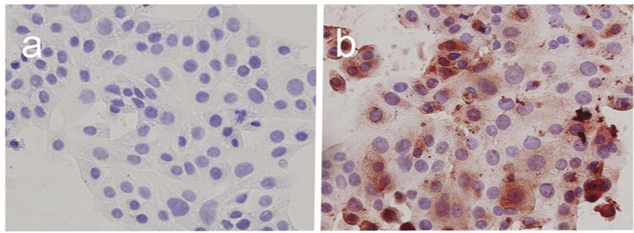
图a是对照组,只有细胞核被染成紫色;图b是实验组,加入HMOCC-1一抗和酶标记的HRP二抗后,细胞质被染成棕色。
二、细胞免疫荧光染色
1.实验原理
细胞免疫荧光(Immunofluorescence,IF)的实验原理是将已知抗体或抗原标记荧光素,用此特异性试剂浸染含有相应抗原或抗体的细胞标本,借助抗原抗体特异性结合,于抗原或抗体的存在部位呈现荧光,从而定位细胞中的抗原或抗体。
2.实验原理图

3.实验步骤
3.1 将爬片置于24孔培养板中,并加入对数生长期细胞,待细胞长成单层,取出爬片,用PBS清洗2次(悬浮生长的细胞离心后用PBS离心洗涤2次,制成细胞涂片);
3.2 弃去细胞培养上清,PBS清洗;
3.3 用4%的多聚甲醛固定爬片15 min;
3.4 PBS 清洗3次,每次5 min;
3.5 用0.5% Triton X-100渗透5 min,在封闭缓冲液中封闭细胞60 min;
3.6 吸去封闭缓冲液,加入稀释后的一抗,4 °C 孵育过夜;
3.7 PBS 漂洗3次,每次5 min;
3.8 加入稀释好的二抗,置于室温下湿盒中避光孵育1 h;
3.9 PBS漂洗3次,每次5 min;
3.10 滴加1×DAPI避光孵育10 min,并用PBS漂洗3次,每次5 min;
3.11 用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
4.实验结果示例
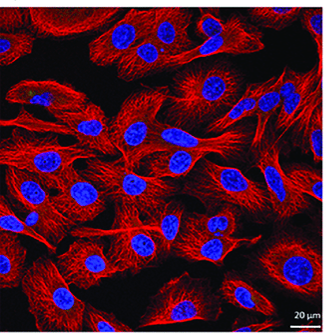
细胞核被DAPI染成蓝色,而细胞质中的蛋白被特异性抗体检测出,在荧光显微镜下呈红色。
三、BrdU/EdU染色
1.实验原理
BrdU(5-Bromo- 2’-deoxuuridine)是胸腺嘧啶的衍生物,可替代胸腺嘧啶选择性整合到新合成的DNA中(细胞周期S期)。这种掺入可以稳定存在,并随着DNA复制进入子细胞中。利用BrdU特异性抗体可以检测掺入的BrdU。EdU(5-Ethynyl-2'-deoxyuridine)是一种胸腺嘧啶核苷类似物,能够在DNA复制时期代替胸腺嘧啶掺入正在合成的DNA分子中,并基于Apollo®荧光染料与EdU的特异性反应即可直接地检测出处于增殖期的细胞。
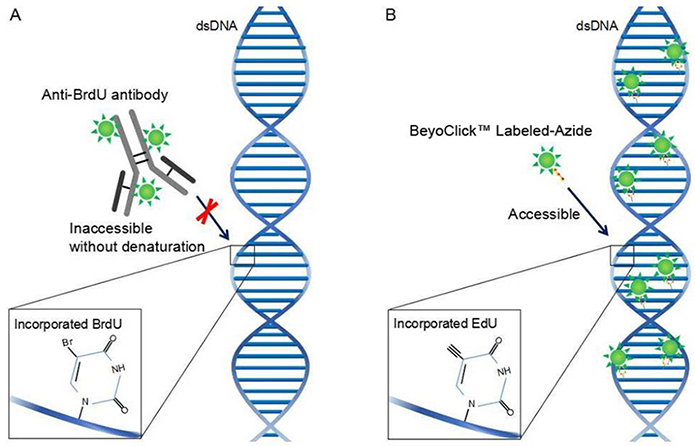
虽然BrdU和EdU两种方法都能检测出增殖期细胞,但两者也有不同。Brdu抗体较大,必须先对DNA进行部分变性形成单链,才能与BrdU结合进而完成检测;而EdU只有BrdU抗体大小的1/500,在细胞内更容易扩散,无需DNA变性即可有效检测,可有效地避免样品损伤,具有更高的灵敏度和更快的检测速度。
2.实验原理图
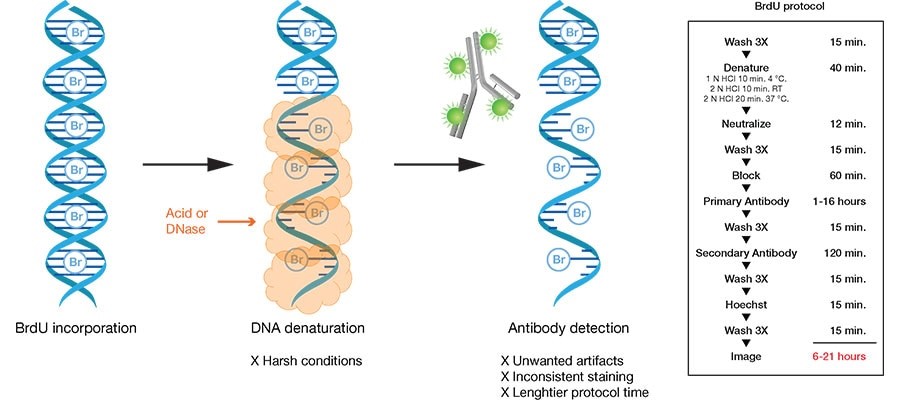
BrdU染色原理△
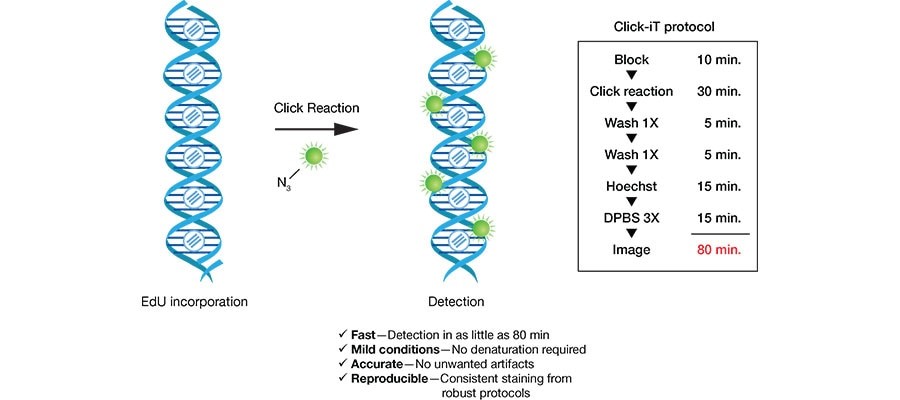
EdU染色原理
3.实验步骤
3.1 BrdU染色
3.1.1 细胞以1.5×105/mL接种于直径35 mm培养皿中(内放置一个盖玻片),培养24 h,用含0.4% FBS培养液同步化3天,使绝大多数细胞处于G0期;
3.1.2 加入BrdU,使得BrdU的终浓度为0.03 μg/mL,置于37 ℃,5% CO2细胞培养箱中孵育1 h;
3.1.3 弃培养液,用PBS洗涤玻片3次,4%多聚甲醛固定30 min;
3.1.4 PBS洗3次后,加入2 mol/L的HCL,置于37 ℃条件下变性5 min;
3.1.5 加入0.1 mol/L的硼酸钠中和10 min,PBS洗3次;
3.1.6 加入0.2% Triton X-100通透10 min;
3.1.7 PBS洗3次,加入3% BSA室温封闭1 h;
3.1.8 PBS洗3次,加入BrdU抗体,4℃过夜孵育;
3.1.9 PBS洗3次,加入二抗,室温避光孵育1 h;
3.1.10 PBS洗3次,加入1× Hoechst 33342避光孵育10 min;
3.1.11 PBS洗3次,并在荧光显微镜下观察拍照。
3.2 EdU染色
3.2.1 培养细胞的EdU标记及固定、洗涤和通透
3.2.1.1 取对数生长期细胞,以每孔1×105个细胞(具体密度取决于细胞的生长率)接种到96孔板中,待细胞恢复到正常状态后,进行所需的药物处理或者其它刺激处理;
3.2.1.2 配制2× EdU工作液,37 ℃预热后,等体积加入96孔板中,使96孔板中的EdU终浓度变为1×。更换所有的培养液可能会对细胞的增殖有影响,因此不建议替换所有的培养液;
3.2.1.3 继续孵育细胞2 h。该孵育时间的长短取决于细胞生长速率,通常孵育时间为该细胞周期的10%左右;
3.2.1.4 EdU标记细胞完成后,弃去培养液,并加入1 mL固定液,室温固定15 min;
3.2.1.5 弃去固定液,每孔用1mL洗涤液洗涤细胞3次,每次5 min;
3.2.1.6 弃去洗涤液,每孔用1mL通透液室温孵育15 min;
3.2.1.7 弃去通透液,每孔用1mL洗涤液洗涤细胞2次,每次5 min;
3.2.2 EdU检测
96孔板中每孔的反应体系为50 μL的反应混合物,6、12、24、48和384孔板对应的反应混合物体系分别为500 μL、200 μL、100 μL、70 μL和20 μL。
3.2.2.1去除上述孔中的洗涤液,每孔加入50 μL Click反应液(参考下表组分顺序和体积配制Click反应液,并且在配制后15 min内使用),轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品;
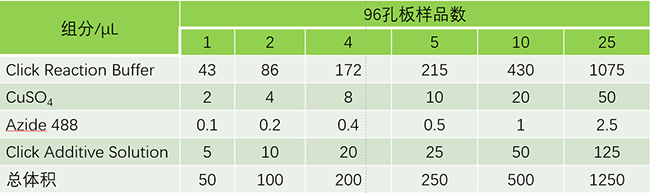
3.2.2.2 室温避光孵育30 min;
3.2.2.3 吸除Click反应液,用洗涤液洗涤3次,每次5分钟;
3.3.3 细胞核染色
为了检测细胞增殖的比例,可以考虑使用Hoechst 33342进行细胞核染色;
3.3.3.1 吸除洗涤液后,每孔加1× Hoechst 33342溶液1 mL,室温避光孵育10 min;
3.3.3.2 吸除1× Hoechst 33342溶液;
3.3.3.3 用洗涤液洗涤3次,每次5 min;
3.3.3.4 随后即可进行荧光检测。Hoechst 33342为蓝色荧光,最大激发波长为346 nm,最大发射波长为460 nm。
4. 结果示例
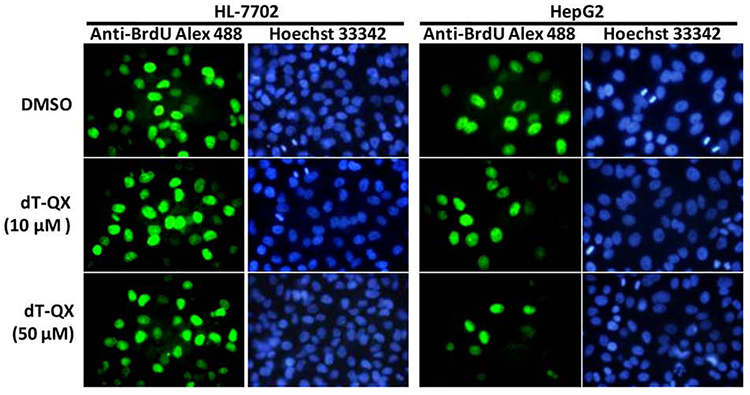
在荧光显微镜下,Hoechst 33342将细胞核染成蓝色;BrdU抗体结合到掺入到细胞DNA中的BrdU,呈绿色。在加dT-QX药物处理后BrdU阳性染色细胞比例明显减少。
四、TUNEL染色
1.实验原理
TUNEL染色即TdT介导的脱氧三磷酸尿苷缺口末端标记法(TdT-mediated Dutp Nick-End Labeling),其原理是荧光或者生物素等标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂的DNA的3'-OH末端,再通过荧光激发或者化学显色的方法,特异准确地检测发生凋亡的细胞,而正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3'-OH形成,很少能够被染色。
2.实验原理图
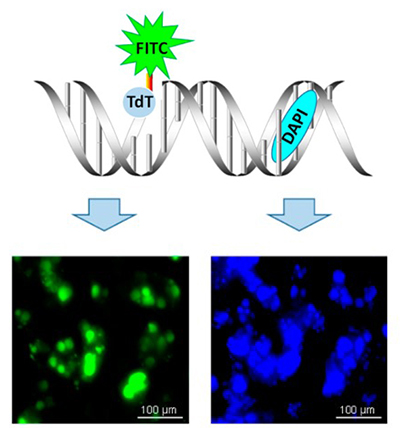
3.实验步骤
3.1 根据实验要求对细胞进行处理后,用PBS洗涤1次;
3.2 用4%多聚甲醛固定30 min;
3.3 PBS洗涤1次;
3.4 加入0.2%的Triton X-100,冰浴孵育2 min;
3.5 加入TUNEL反应混合液,盖上盖玻片,置于暗湿盒中,37 ℃孵育1 h;

3.6 PBS漂洗3次;
3.7 加入DAPI,避光孵育10 min;
3.8 PBS洗3次后,荧光显微镜下观察、拍照。
4.实验结果示例
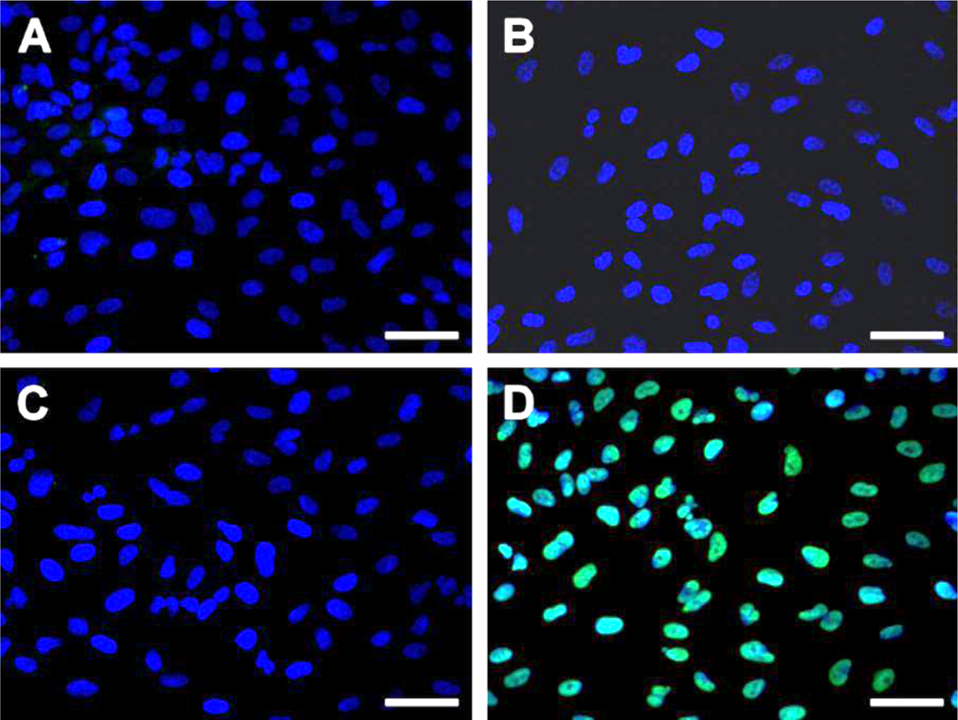
荧光显微镜下,细胞核呈蓝色荧光,凋亡细胞呈绿色荧光。
参考文献
[1] Jain D, Nambirajan A, Borczuk A, Chen G, Minami Y, Moreira AL, Motoi N, Papotti M, Rekhtman N, Russell PA, Savic Prince S, Yatabe Y, Bubendorf L; IASLC Pathology Committee. Immunocytochemistry for predictive biomarker testing in lung cancer cytology. Cancer Cytopathol. 2019 May;127(5):325-339.
[2] Kyuseok, Im, Sergey, et al. An Introduction to Performing Immunofluorescence Staining.[J]. Methods in Molecular Biology, 2019.
[3] Harris L, Zalucki O, Piper M. BrdU/EdU dual labeling to determine the cell-cycle dynamics of defined cellular subpopulations. J Mol Histol. 2018 Jun;49(3):229-234.
[4] Moore C L, Savenka A V, Basnakian A G. TUNEL Assay: A Powerful Tool for Kidney Injury Evaluation[J]. International Journal of Molecular Sciences, 2021, 22(1):412.
[5] Loo D T. In situ detection of apoptosis by the TUNEL assay: an overview of techniques.[J]. Methods in Molecular Biology, 2011, 682:3-13.
[6] Sharma R, Iovine C, A Ga Rwal A, et al. TUNEL assay—Standardized method for testing sperm DNA fragmentation[J]. Andrologia, 2020(4).