免疫印迹(western blotting)是利用抗原抗体特异反应特性,定性检测样本中目的蛋白表达量;是检测基因蛋白表达量最常用的方法,广泛应用于基础科研领域。
1. 实验原理
在电场作用下,通过聚丙烯酰胺凝胶电泳将总蛋白根据分子量大小进行分离,然后将其转印至固相载体(硝酸纤维膜或PVDF膜)。载体膜与特异识别特定抗原的抗体孵育后,再与辣根过氧化物酶标记的二抗特异结合。最后加入辣根过氧化物酶底物显色(暗室曝光或化学发光成像),结合显色条带光密度分析目标蛋白表达量。
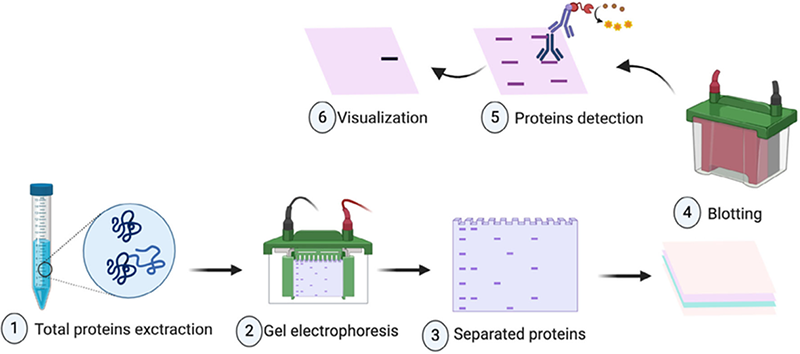
2. 实验步骤
2.1 总蛋白提取
2.1.1 组织样本:组织块用预冷的PBS洗涤2-3次,去除血污,称重,剪成小块置于匀浆管中,加入匀浆珠,每10 mg组织加入100 μL组织裂解液(使用前数分钟内加入蛋白酶抑制剂),设置匀浆程序进行匀浆。匀浆结束后,放置冰上孵育30 min,每隔5 min震荡1次确保组织完全裂解。12000 rpm,4 ℃,离心10 min,收集上清,即为组织总蛋白溶液。
2.1.2 细胞样本:弃去培养板中的培养基,加入适量4 ℃预冷的PBS洗涤细胞2-3次,并弃去洗涤液。按说明书加入适量裂解液(含PMSF和磷酸酶抑制剂)至培养板中,使用移液器吹打混匀,冰上孵育20 min。 裂解完成后,用移液器将裂解液移至2 mL离心管中,并4 ℃,12000 rpm,离心10 min,收集上清,利用BCA法测定蛋白溶液浓度,并且将各组样本蛋白浓度均一化,调整至相同浓度。保存上清于-20 ℃或-80 ℃备用。
2.2 凝胶电泳
2.2.1制胶: 根据所要分析的蛋白质分子量大小配制分离胶,沿玻璃板上的左上角位置连续平稳注入两层玻璃板中,待分离胶聚合凝固后,灌注浓缩胶溶液并立即插入胶梳,充分聚合后即可使用。
2.2.2蛋白变性:取出细胞裂解液按比例加入5×Loading Buffer混匀,于沸水中煮沸5 min,立即冰上放置。
2.2.3上样电泳:正确放置电泳槽,加入电泳液,上样,先恒压80 V电泳25 min,待溴酚蓝指示蛋白压缩完成后,将电压调至120 V,继续电泳,直到溴酚蓝快要到达凝胶底部。
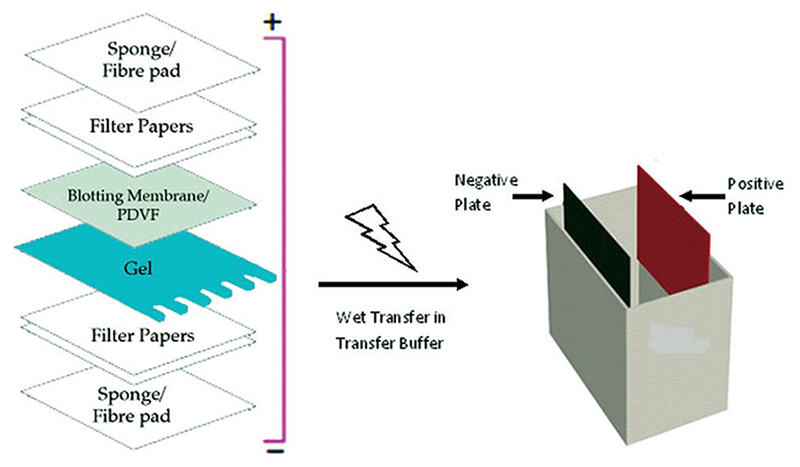
2.3 电转移
将凝胶玻璃板从电泳槽中取下,切去不用的部分,根据凝胶的尺寸剪裁和凝胶一样大小的固相膜,再放入电转膜液中浸泡激活;同时剪裁2张滤纸,放入转膜缓冲液中泡透。按阴极→滤纸→凝胶→固相膜→滤纸→阳极的顺序放置在转膜仪上,赶压气泡。接通电源,选择恒流模式,按1.5 mA/cm2凝胶计算转膜用电流,转膜45 min。
2.4 免疫反应
2.4.1 将膜用TBST冲洗5 min后,移至用TBST配置的5%脱脂奶粉封闭液中,室温下摇床上封闭2 h。
2.4.2 将一抗用抗体稀释液稀释至适当浓度,从封闭液中取出膜,再放入新抗体孵育袋中,加入一抗液,挤赶气泡,封口,4 ℃ 孵育过夜。
2.4.3 次日取出膜,用TBST在室温下摇床上洗涤3次,每次5 min。
2.4.4 根据一抗准备相应种属二抗稀释液并与膜一起孵育1 h。
2.4.5 转移二抗稀释液,用TBST在室温下摇床上洗3次,每次5 min。
2.4.6 显色液A、B液比例为1:1,化学发光,采集照片,保存原始图片。
3. 结果示例
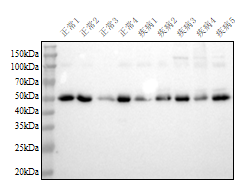
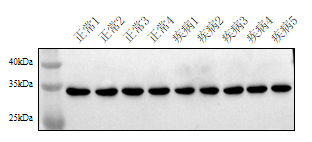
该结果反应了不同样本,在相同处理及检测条件下能清晰的看出蛋白表达情况(右图为对照内参GAPDH)。
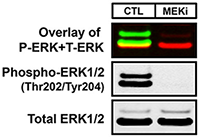
使用红外荧光的高质量和低质量的蛋白质印迹图像的一个例子。用DMSO(CTL)或2 μM的MEK抑制PD0325901(MEKi)处理WM793黑色素瘤细胞18 h。选用的是兔抗磷酸化ERK1/2(Thr202/Tyr204)、小鼠抗总ERK1/2。第一个Western blot面板是同时检测磷酸化ERK1/2(800nm通道-绿色)和总ERK1/2(700nm通道-红色)荧光信号的叠加。第二个和第三个面板是磷酸化和总ERK1/2的单通道荧光图像的黑白图像。
参考文献
[1] G.J. Anderson, C.M. Cipolla, R.T. Kennedy, Western blotting using capillary.electrophoresis, Anal. Chem. 83 (2011) 1350–1355.
[2] A.J. Hughes, A.E. Herr, Microfluidic western blotting, Proc. Natl. Acad. Sci. U. S. A. 109 (2013) 21450–21455.
[3] S.Q. Tia, M. He, D. Kim, A.E. Herr, Multianalyte on-chip native western blotting,Anal. Chem. 83 (2011) 3581–3588.
[4] S. Jin, G.J. Anderson, R.T. Kennedy, Western blotting using microchip electrophoresis interfaced to a protein capture membrane, Anal. Chem. 85 (2013) 6073–6079.
[5] A.J. Hughes, D.P. Spelke, Z.C. Xu, et al., Single-cell western blotting, Nat. Methods 11 (2014) 749–755.