以下文章来源于微信公众号实验老司机 ,作者高工
疾病细胞模型的种类很多,应对不同,建模方式可能就不同。
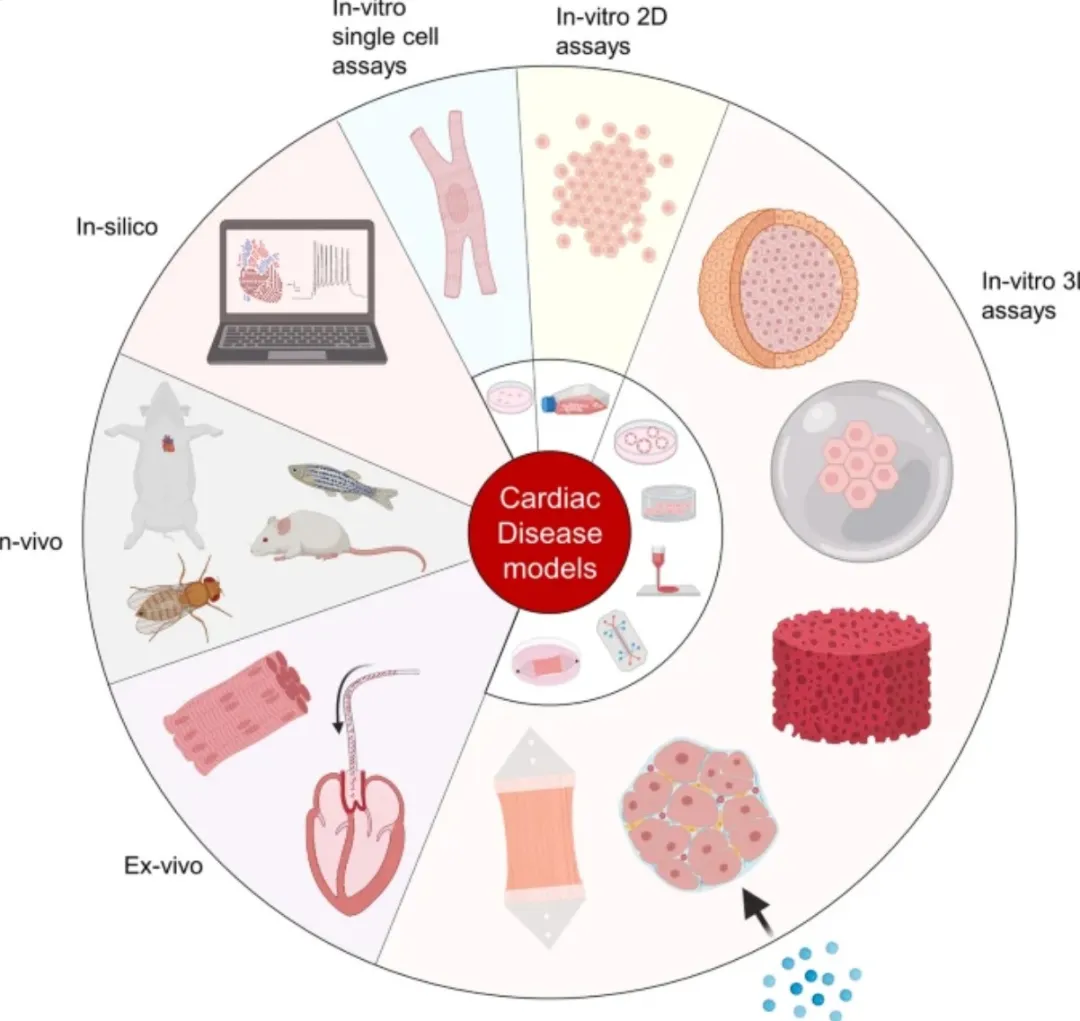
图:springer
所以,这里要和大家强调:构建疾病细胞模型,得根据要解决的问题来做,不是简单复制疾病,因此没有一招通吃的办法。
其核心是模拟疾病怎么发生的,这样我们才能从中找到疾病的机制、影响因素,或者验证药物效果。
本文会着重讲构建模型的一般原则 —— 不针对某一种具体疾病,只说怎么规划建模,合格的模型要满足什么条件。
整体思路可以分成三步:分析疾病机制、建模、验证。
建模得跟着研究问题和目的走。
我们不是在实验室里简单模仿疾病,而是要重现疾病的发生过程,用来解决科学问题。
所以这个过程是反过来的:从要解决的问题入手,把疾病的核心病理特点拆解开,在实验室里用可控、相关的方法重现这些特点,同时还要找到能衡量疾病严重程度的具体指标。
研究疾病机制:比如你要找致病的分子标志物、信号通路哪里出了问题,或者找药物靶点。这种情况可能需要还原导致疾病的外界条件。
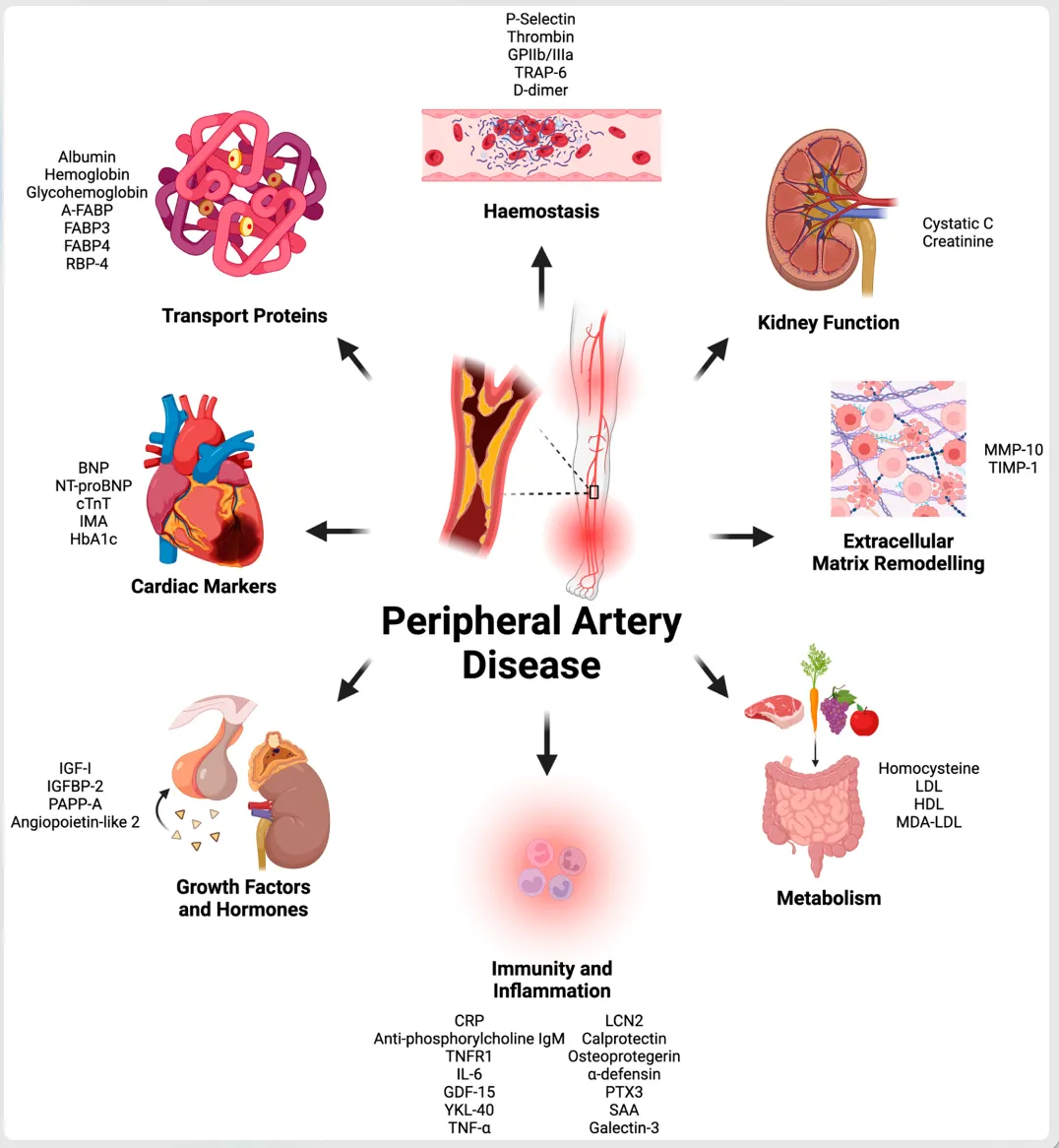
图:MDPI
评估药物效果:比如你已经有了药物分子,要筛选或验证它有没有用。那模型就得复制疾病的特征和标志物,而且能稳定反映药物的作用 —— 药有效没效,模型能清楚体现。
不同致病因素,会影响建模方式:
外界影响:有些致病因素不在细胞自身,是外界刺激导致的。比如三高(高血压、高血糖、高血脂)这类代谢病、毒素中毒、物理损伤、感染性疾病。这种情况建模容易,只要给细胞相应的刺激就行。
图:labx
细胞自身问题:比如基因突变、基因表达异常、信号通路调控出问题。这种情况更复杂,可能需要做基因编辑 —— 比如敲除某个基因、加入某个基因。
建模时,得有能量化的指标,用来判断疾病的严重程度:
形态学:用染色的方法,在显微镜下能看到的变化。比如细胞皱缩、细胞里出现油滴。
图:researchgate
生化指标、分子标志物:用分子生物学实验(比如 WB、qPCR、ELISA、临床生化检验)能测到的分子变化。比如活性氧、甘油三酯、ATP 的水平,或者特定基因、蛋白的表达量变多还是变少。
生理功能:比如细胞吸收葡萄糖的速度、线粒体呼吸的效率、细胞凋亡的比例。
如果疾病是外界刺激引起的,就在细胞培养基里加外源刺激物。
比如:做高脂模型,加过量游离脂肪酸;做结核病细胞模型,用结核杆菌感染细胞;研究高温对细胞的损伤,就把细胞放在高温环境下培养。
有些情况需要研究遗传相关的问题:比如临床上遇到特殊患者,想找致病机制;或者想研究某个蛋白对疾病的影响。这时就得用基因编辑、RNAi 这类技术,精确让某个致病基因 “沉默”、敲除,或者加入某个致病基因。
有些疾病不只是细胞自身的问题,细胞所处的微环境、细胞之间的互动也很重要。比如现在热门的肿瘤微环境、免疫相关研究。这时就得把两种甚至多种细胞放在一起培养,模拟细胞间的相互作用。
细胞类型会影响模型效果,常用的有三种:商品化细胞系、干细胞、原代细胞。(原代细胞若需保留特定个体遗传背景、研究多向分化潜能,常需重编程为诱导多能干细胞(iPSC))。
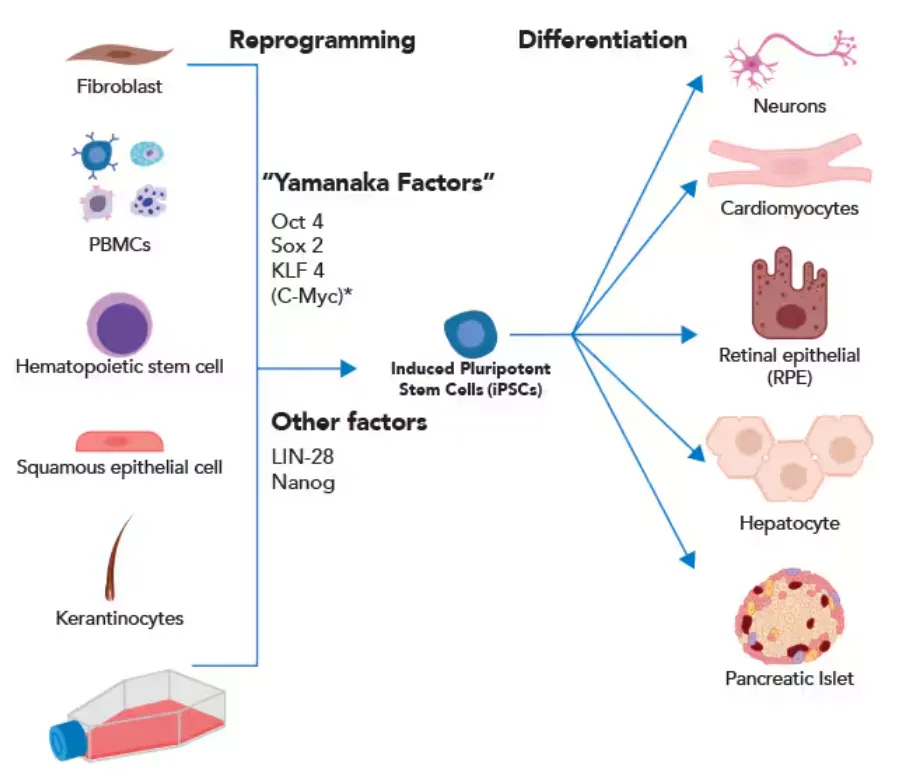
图:novusbio
选细胞要结合前面的疾病机制和建模策略:
如果是外界刺激导致的疾病,不涉及遗传变化,用商品化细胞系就行。如果要研究致病基因、信号通路,可能需要做基因编辑,这时要按研究目的选细胞类型。
做完前面的步骤,得验证模型是不是成功了,确保在模型上拿到的数据有代表性:
1. 得确保模型能稳定表现出我们想要的疾病特征(表型)。
2. 另外,因为是细胞模型,还得验证模型的特征和人体数据是相关的。比如在模型里发现 “基因 A 上调会导致疾病”,那真实患者身上也应该有 “基因 A 表达上调” 的特点。
图:MDPI
拿开头说的高脂模型举例,具体拆解构建思路 —— 比如要筛选能治非酒精性脂肪性肝病(NAFLD)的药物,需要做这个病的细胞模型:
1. 建模目的:用于药物筛选。
2. 致病因素:外界过量脂质持续刺激,先导致细胞里脂质异常堆积,再引发炎症反应和细胞损伤。
3. 构建方式:在培养基里加油酸钠、棕榈酸钠,模拟高脂环境,让细胞摄入脂质,实现细胞内脂质异常堆积。
4. 选细胞:不用涉及基因调控,用商品化的人源肝细胞系(比如 HepG2)就行。
5. 评价指标:
形态学:用油红 O 染色,看细胞里有没有脂肪堆积。
生化指标、分子标志物:测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)—— 这两个指标能判断肝细胞有没有损伤;用 ELISA 测炎性细胞因子,判断有没有炎症;如果需要,还能测 ROS 水平(看有没有氧化应激),或者用 WB 实验测相关蛋白质水平,进一步验证。
6. 验证:前面测的形态数据和分子数据,结果要一致(比如既看到脂肪堆积,又测到 ALT/AST 升高),模型才算合格。