奥格诺德(ORG)基质胶(Orgmatrix gel)
源头厂商·诚招代理
癌症是主要的健康问题,也是造成世界范围内死亡的首因。早期癌症检测和治疗策略的不断攀变提高了患者的总体生存率,尤其是靶向药物为个性化癌症治疗提供了新的机会。然而,个性化治疗尚缺少能预测患者对某种药物反应的模型。近年来最有希望的突破之一是类器官技术。类器官培养物表现出自我更新能力、自我组织能力和长期增殖能力。类器官已被证明保留了它们来源的癌症组织的异质性和遗传特性。癌症类器官的生成在短时间内(数周)完成,通常效率很高,并且培养物通常可以无限次传代。所有胃肠道组织,包括食道、胃、肝、胰腺、小肠和结肠直肠组织,以及这些组织的癌症均可以生成类器官。患者来源的类器官 (patient-derived organoid,PDO) 库构成了“活的”生物库,可以深入分析组织功能、发育、肿瘤发生和癌症病理生物学。PDO 适用于各种技术,包括测序分析、药物筛选、靶向治疗测试、肿瘤微环境研究和基因工程能力。胃肠道类器官被广泛用于基础癌症生物学和临床转化研究。
2009 年,首先从肠道隐窝或基于亮氨酸重复序列的 G 蛋白偶联受体 5阳性( Lgr5+) 肠干细胞建立了小鼠小肠类器官。通常,成体干细胞,胚胎干细胞或诱导的多能干细胞衍生的类器官嵌入富含层粘连蛋白的 ECM(如 Matrigel® 或基底膜提取物 (BME®))中,在补充生长因子的培养基中培养维持干细胞生态位,从而允许自我更新和长期增殖(图1a)。2009年,进一步发展出了气液界面(ALI)培养肠类器官形式,这个体系允许上皮细胞以及周围的基质,包括成纤维细胞和免疫细胞,与类器官一起培养,更贴近组织(图1b)。此外还发展了应用特定的逐步分化方案,引导多能干细胞 进入感兴趣的组织的类器官培养模式,最终允许完全生长的类器官嵌入 ECM 和补充生长因子培养基中(图1c)。
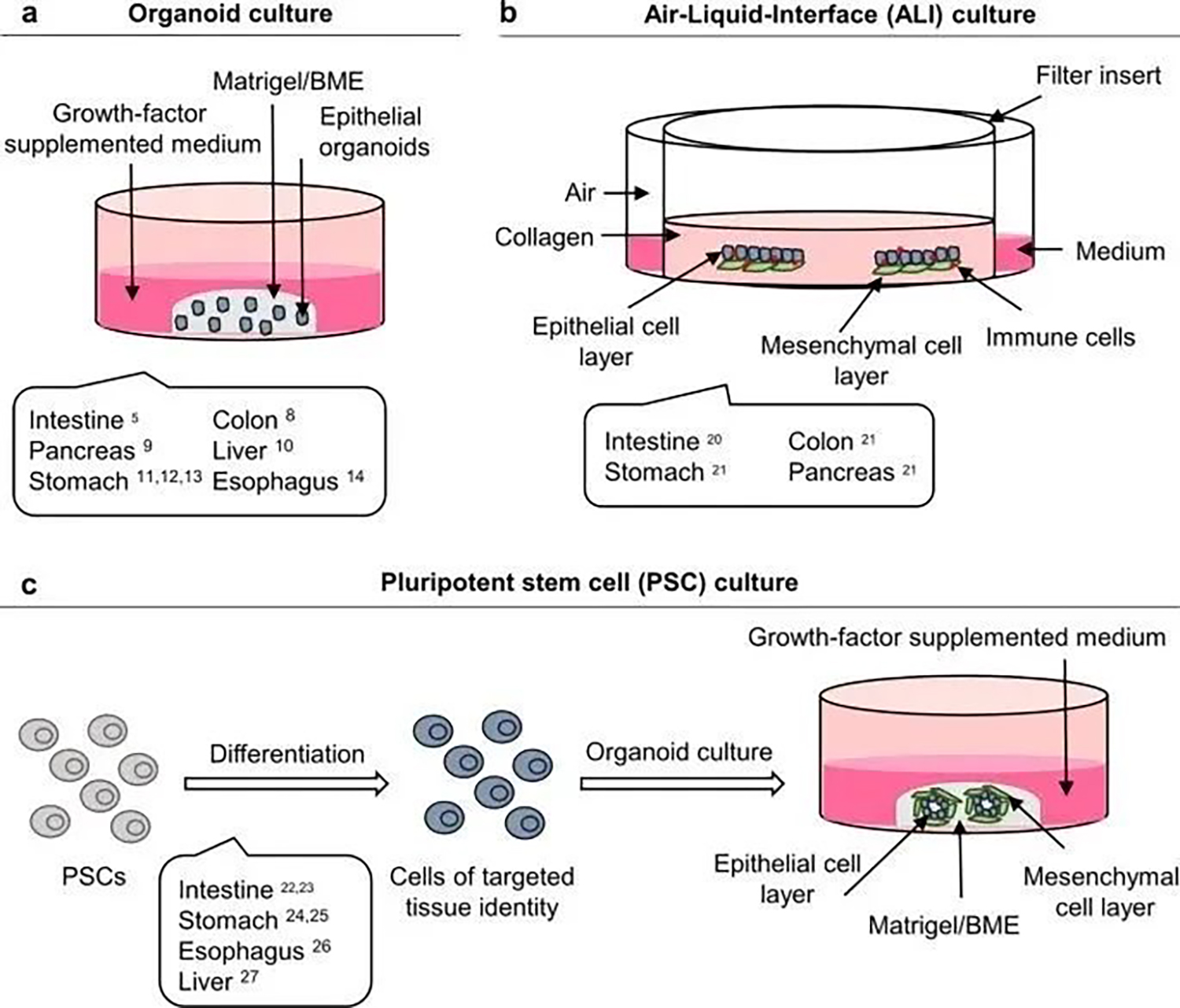
图1
a 成体干细胞衍生的上皮类器官嵌入富含层粘连蛋白的细胞外基质样(Matrigel ®或 BME ®)中,并覆盖生长因子补充培养基。b 在气液界面 (ALI) 类器官培养方法中,上皮组织与周围基质一起培养,包括成纤维细胞和免疫细胞。组织在 I 型胶原基质中生长,该基质位于 Transwell 插入物的顶部,该插入物包含为细胞提供生长培养基的渗透膜。c 多能干细胞 (PSC) 衍生的类器官通过逐步分化方案生成,引导 PSC 进入感兴趣的组织。PSC 衍生的类器官也嵌入 Matrigel ®或 BME®并覆盖生长因子补充培养基。
胃肠癌类器官在癌症研究中的应用简介
从肿瘤活检中生成的源自患者的类器官 (PDO) 在转化癌症研究中有许多应用,包括测序分析、药物筛选、靶向治疗测试、肿瘤微环境研究和使用 CRISPR/Cas9 技术的基因工程能力,以及其他应用(图2)。
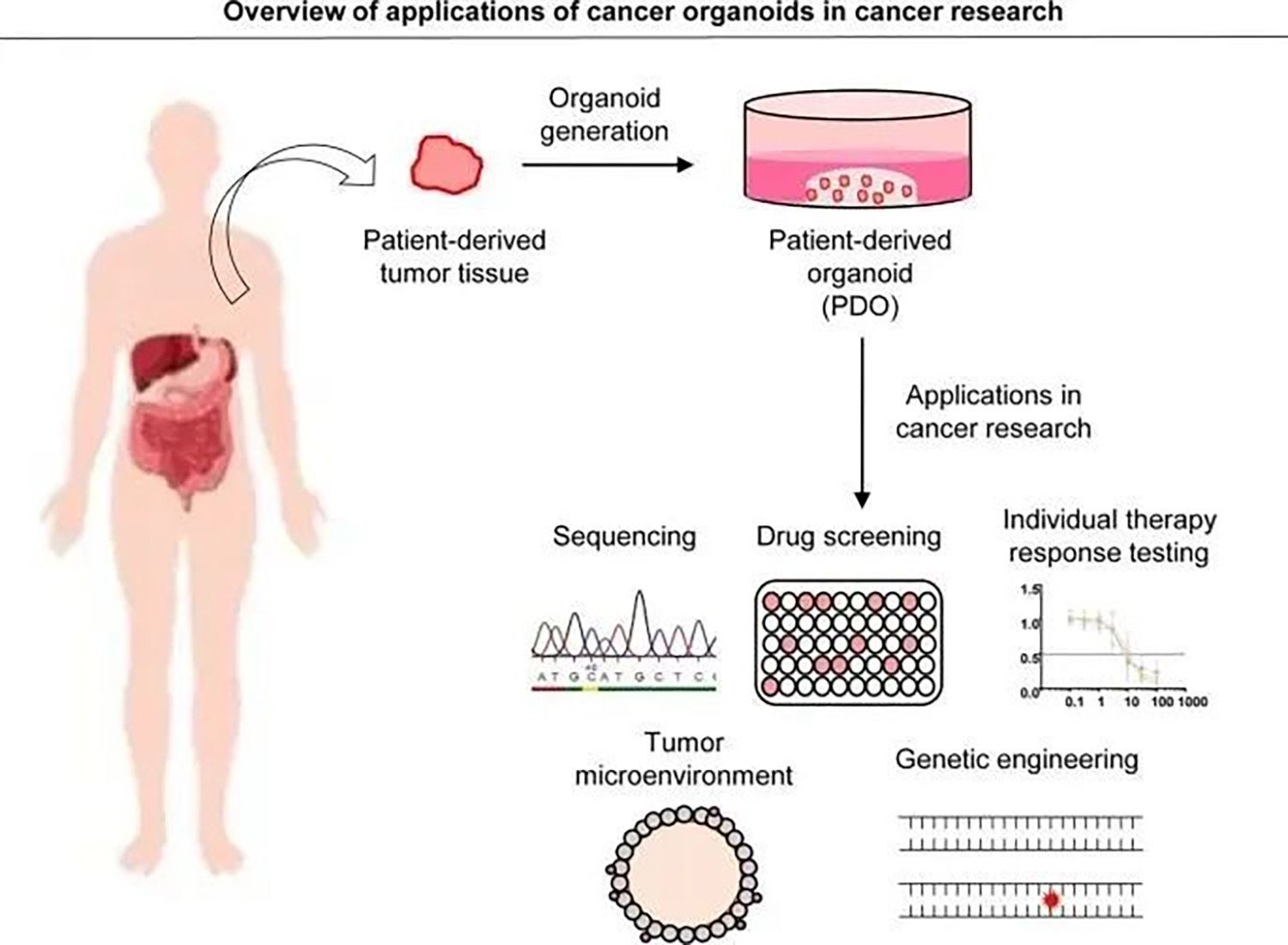
图2
使用高通量测序技术分析突变
一系列研究表明 PDO 文库可以从各自的胃肠道癌症实体中生成,并且它们在分子上类似于它们所源自的肿瘤,能代表类似于体内病理学状态用于癌症病理学研究。PDO 的测序可以识别在原发肿瘤样本中检测不到的低频率亚克隆突变。
药物筛选以定义新的治疗策略
PDO 可能更好地概括原发肿瘤,因此可能代表更准确的药物筛选和发现模型。迄今为止,已经报道了对活的胃肠道 PDO 生物库的不同药物筛选方法(图3b)
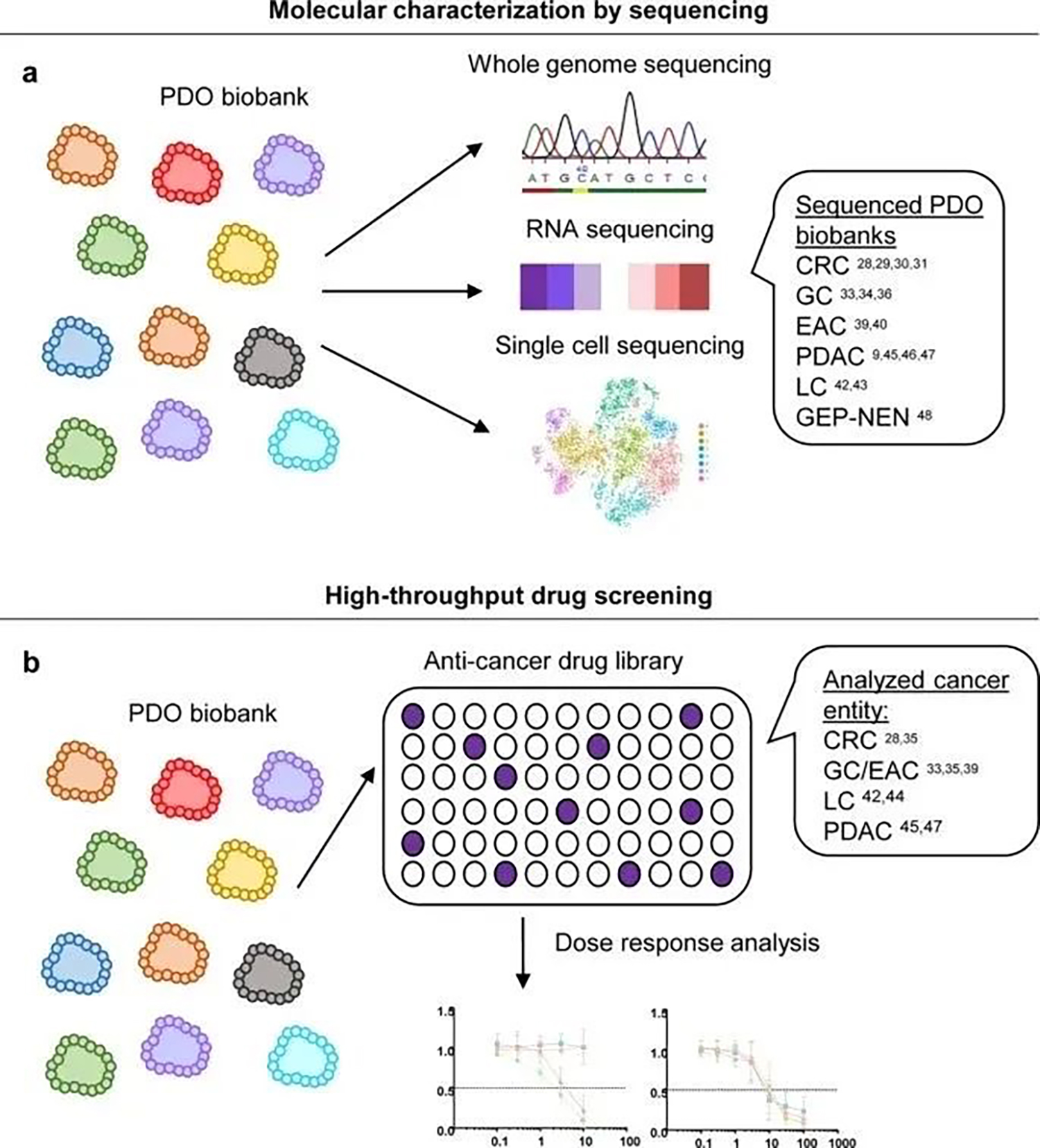
图3
a 胃肠道癌症的PDO 生物库的表征特点包括全基因组测序、RNA 测序和单细胞测序。b 已经报道了使用不同大小的 PDO 生物库对抗癌药进行高通量药物筛选分析,和剂量反应分析。迄今为止,几项联合临床研究已经表明 PDO 的准确性很高,可以正确预测治疗反应。现在重要的是需要优化培养成功率和增殖效率的方案,以便及时进行药物测试。这对于将 PDO 整合到前瞻性临床试验中至关重要。
基于个体 PDO 测试的个性化医疗
个性化癌症治疗的主要前提是存在反应潜在药物靶点的患者特异性改变和通路畸变。PDO 的分子分析、药物分析和靶向治疗测试揭示了不同癌症实体的有希望的结果。迄今为止,不同的临床研究已经确定了 PDO 作为治疗方案预测测试的可行性和潜在用途(图4)。
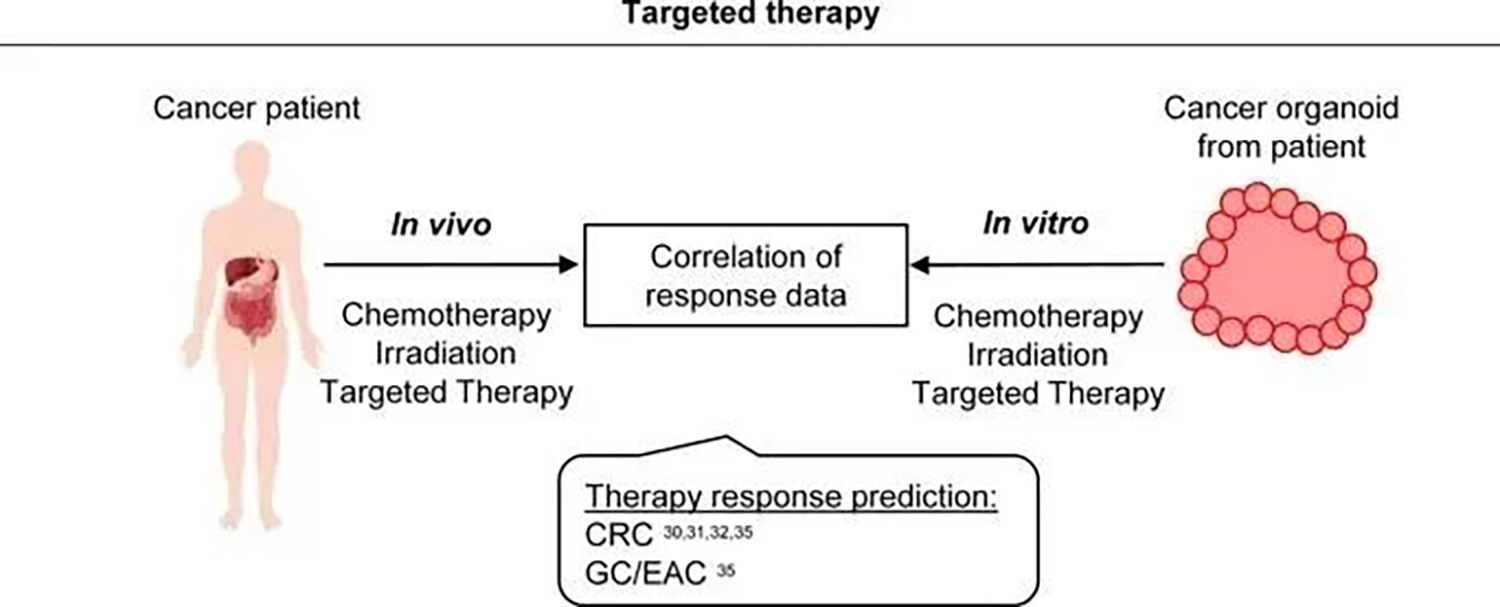
图4
肿瘤内异质性和肿瘤演变的研究
PDO 现在提供了研究肿瘤内异质性的功能相关性,即遗传差异是否对生物学行为和药物反应产生影响(图5a)。通过比较来自患者原发部位和转移部位的 PDO,癌症类器官也被用于研究肿瘤演变(图5b)。 来自原发性肿瘤和弥漫型 GC 淋巴结转移的 PDO 仅显示出一些差异。然而,在混合型 GC 中发现了显著差异,因为原发肿瘤和转移瘤之间只有 23% 的突变是共享的。组织学上,原发肿瘤呈弥漫性生长模式,而淋巴结转移呈腺体形态。来自不同肿瘤区域和不同转移扩散部位的 PDO 在分子特征上表现出相似性,例如在驱动基因突变方面,但在药物反应或转移能力方面差异显著。这强调了 PDO 作为“生命系统”的价值,使研究人员能够进行功能分析,例如药物测试和转移分析,以揭示重要的差异。
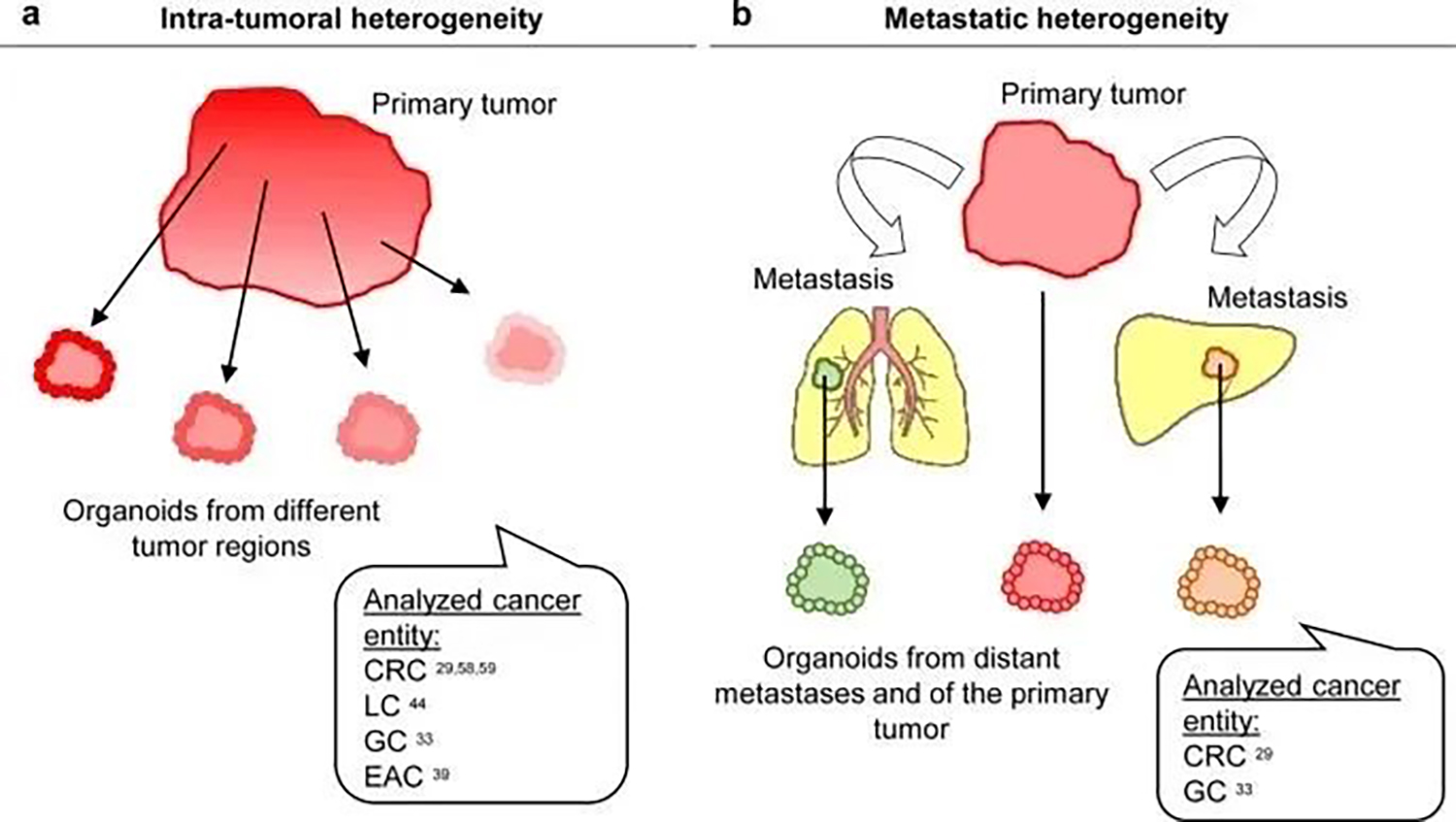
图5
使用 PDO 研究肿瘤微环境
肿瘤微环境在肿瘤的发展和进展中起着至关重要的作用,因为肿瘤和环境之间的双向信号促进了肿瘤的生长。例如,癌相关成纤维细胞(CAF中)有潜力分泌ECM分子和能够进一步刺激肿瘤生长,细胞存活和转移可溶性因子。微环境对肿瘤生长或治疗抗性的积极影响提供了新的干扰治疗点。迄今为止,微环境与肿瘤细胞的相互作用主要仅在体内研究。然而,癌症类器官通常由纯肿瘤细胞组成,没有额外的基质或免疫细胞。例如成纤维细胞通常在体外初始类器官培养中观察到,但在培养的早期丢失。来自不同恶性肿瘤的 PDO 与基质、免疫或嵌合抗原受体(CAR )细胞的共培养分析在发现和开发新的治疗策略中的具有潜力,这些策略将有助于靶向癌细胞生长基质或引导T细胞识别杀伤癌细胞。
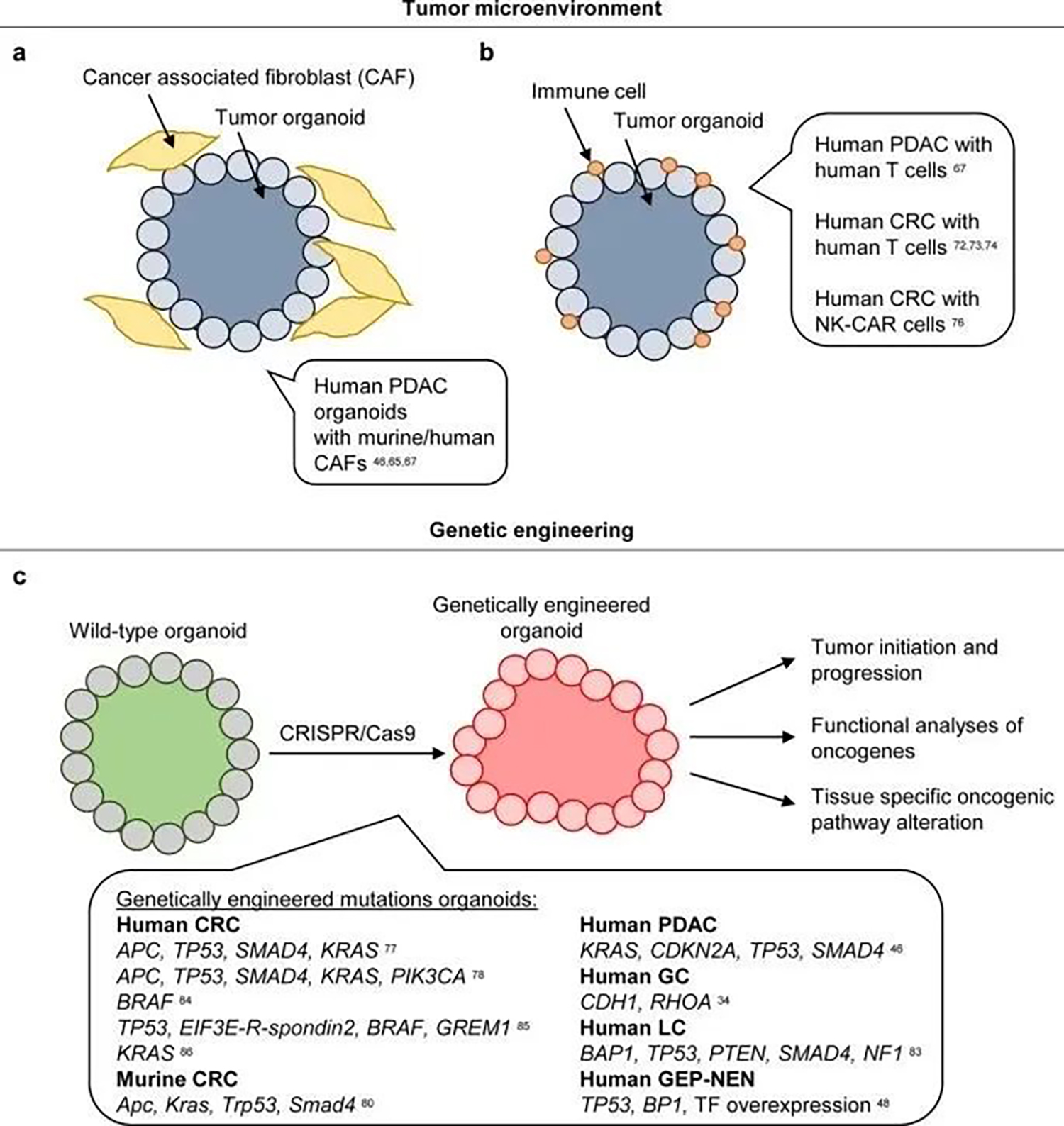
图6
基因工程改造健康组织来源的类器官进行癌症建模
健康组织来源的类器官的基因操作,例如,通过 CRISPR/Cas9,能够生成特定遗传背景的模型。这些模型是研究初始恶性转化、某些改变的信号通路对感兴趣组织的影响或推定致癌候选基因(图6c)的功能分析等的理想工具。除了生成在晚期癌中具有多种改变的类器官模型外,CRISPR/Cas9 技术还可用于研究肿瘤亚型的早期肿瘤发生。CRISPR/Cas9技术不仅可以用于突变基因,还可以用于诱导由缺失或倒位以及染色体间易位产生的染色体融合。CRISPR/Cas9 还可用于通过专门改变某个途径来描述治疗策略。总之,CRISPR/Cas9 技术为人类环境中癌症基因和通路的机制研究提供了一个极好的实验平台。
各种癌症的类器官培养物对癌症研究产生了巨大影响,广泛用于基础和转化癌症研究。个体 PDO 是肿瘤研究的最佳模型,这可能有助于临床医生通过预测对抗癌药物的反应来在个体水平上定制治疗策略。然而,一些癌症实体(例如,肉瘤)不容易形成类器官,并且某些已成功的类器官成功率远未接近 80-90%,表明不同亚型需要特殊生长条件。因此,需要新的方案并对现有培养方法不断改进。另外,培养成本高,各实验室试剂和培养条件不同,需要达成共识。类器官培养会用到Wnt3a,在无血清培养基条件下如何保证其活性是一直以来未被解决的难题,不过通过添加人工合成 WNT3a 激动剂或 Afamin 稳定 WNT3a来解决 . 目前类器官培养面临的最大挑战当然是缺乏微环境。然而,该领域正在迅速发展,并且开发了允许纳入来自肿瘤微环境的细胞,如成纤维细胞和免疫细胞的方案。人类癌症类器官的基因组、转录组和蛋白质组学分析有助于更好地了解肿瘤生物学并定义靶向治疗,类器官的治疗允许直接评估药物的反应。患者和 PDO 并排治疗的联合临床试验显示了类器官在预测治疗反应方面的能力。如果这些结果在前瞻性临床试验中得到证实,PDO 最终可能会参与临床决策。
这里我们对PDO的研究和应用进行了简要介绍,更多的研究内容,大家可以参考原文:https://pubmed.ncbi.nlm.nih.gov/34663939/